- �����������̷���
- ��ѧ���Ӿ�������
- LED/Һ��/��·�徻������
- ʳƷ���Ͼ�������
- ��ױƷ���ջ�����������
- ҽ����е��������
- ҽԺ�����Ҿ�������
- ������ҩ��������
- �ྻʵ���Ҿ�������
- �������Դ��������
- ����/���վ�������
- ���ϻ�����������
- ���/��Ϳ��������
- �ֲ�������ϵͳ����
- �ྻ��/������վ
- ������ˮ��
- ���º�ʪϵͳ
- �ྻ�������豸����
- ���и�Ч����������
- ������/������
- ���ݴ�/�Ծ����ݴ�
- MAC/FFU������
- ��������̨
- ��Ч�����ͷ��
- ��QC(�ྻ��)������ࡢ�������
- ����ҩ������������GMP�淶���������
- ��SMT���ྻ��������ƶȲο�
- ���ྻ������ƶ�
- ������ҩҵ�ྻ�����������(�ڲ�����
- ����ױƷ���������淶ָ�ϣ�GMPC��
- ���人ҩ���ྻ���������Ա���
- ���ྻ���������Ͳ���
- ��ʳƷ��ҵQS��֤ר�����������ֲ�
- ��ǧ���ྻ�������ƶ�
- ��ͨ����յ�����ʩ���������չ淶���
- �����Ҳ��Ա��������
- ����ҩ�������������淶��ѵָ��(����
- ����ISO14644-1��2015�ı仯������
- ����糵����������Ҫ��
- ��ϵ�ˣ�������
- ��ϵ�绰��137-10902965
��ҩ�������������淶��ѵָ��(��ҩGMP��ѵ�̲�)
��ҩ�������������淶��ѵָ��
��ҩGMP��ѵ�̲�
Ŀ¼
��һ�� �� ��
�� ��
һ����ҩGMP�ĸ���
GMP��Ӣ��Good Manufacturing Practice for Drugs����д����ֱ��Ϊ������ҩƷ������ʵ������������ҩƷ�ĸ��������ҩ���ҹ��ġ�ҩƷGMP���ǡ�ҩƷ�������������淶���ļ�ơ�
����ҩGMP���ǡ���ҩ�������������淶���ļ�ơ�����ҩGMP������ҩ��������������������ҩ����ȫ�����У��ÿ�ѧ�������淶���������ͷ�������֤����������ҩ������ѧ��������ϵ������ҩGMP��ʵʩ��Ŀ����Ƕ���ҩ������ȫ���̽����������ƣ��Ա�֤��������ҩ�����Ǻϸ������ġ�
GMP��������ҩ��ҵ��һ�¹��ϵ�ҩƷ(������ҩ)�����������ص����ձ����Ĵ����ǵȹ���������Ϊ��ҩ��ҵ�ı���ִ�еķ�����ʽ�䲼ʵʩ��
��
����GMP����ʷ�������䷢չ�ſ�
��
1����ʷ���� GMP�Ǵ�ҩƷ����ʵ���л�ȡ�����ѵ���ܽᡣ��������ھ�����12�νϴ��ҩ�����ѣ��ر���20���ͳ���������ҩ����������Ӧͣ���¼�����Ҫ���ҩƷ�Ƽ��ϸ�ල�ķ��ɡ��ڴ˱����£�������1962�����ˡ�����ʳƷҩƷ��ױƷ����(Federal Food Drug Cosmetic Act)��
�����GMP��������̹�ն���ѧ6�����ڱ�д�ƶ��ģ�1963�����������һ�ΰ䲼�� ��һ��GMP������FDA(Food and Drug Administration����ʳƷҩ�������)����ʵʩGMP��ȷʵ�յ�ʵЧ��
1967��WHO(����������֯)�ڡ�����ҩ�䡷(1967���)�ĸ�¼��������GMP��1969���22��������������ϣ�WHO�������Ա����ҩƷ��������GMP�ƶȣ���ȷ��ҩƷ�����Ͳμ�������ó��ҩƷ����ǩ֤������ (Certification Scheme on the Quality of Pharmaceutical Products Moving in International Commerce �����ǩ֤������ ) ��1975��11��WHO��ʽ����GMP��1977���28�������������ʱ��WHO��ʼ���Ա���Ƽ�GMP����ȷ��ΪWHO�ķ���֮һ�� GMP�������������ڡ�����������֯��ʽ��¼����226�Ÿ���12���С��Ӵˣ�GMP��ʽ�������磬��Ϊȫ���繫�ϵ�ҩƷ������������ִ�еķ��档�˺��������ձ��ʹ����ŷ���ҿ�ʼ��������֯����ݱ�����GMP��ŷ��ͬ��ίԱ��䲼��ŷ�����GMP������Ϊֹ��ȫ��������100�������ʵʩ��GMP�ƶȡ�����WHO��ŷ���塢�����������ǹ������ˣ��й�̨��ʡ�ȹ��ҡ������䲼��GMP����ȷ�涨����ҩ����Ҳ����ִ��GMP���Ĵ�������1999�껹�䲼�ˡ���ҩ�Ƽ��������������淶����
ֵ��ע����ǣ�һЩ���ҡ�������������֯��������֯��ҩƷ���������淶������ҩ�����������������������ڣ���������ȷ�Ĺ涨��
��������������ҩƷ�������������淶(cGMP)�������й涨���ٲ��ֵ������������û�����ҩƷ�Ʊ�����������ȵ�ҩƷ�������������淶����
��������������֯(WHO)��ҩƷ���������淶�ڵ�����˵������������������WHO�ĵ�һ�桶����ó����ҩƷ����ǩ֤��Ҫ���Ƽ���Ϊ��������������ʱ���õ��˽��ɲ���GMP��Ϊ��Ҫ����ɲ��֡�1975�꡶ǩ֤��Ҫ���õ������䣬������
����ʳ�ö������ҩƷ����
����ŷ��ͬ��ҩƷ�������������淶���䵼����˵�������г�Ա���ͳ��Ҷ�ͬ������������ҩƷ������GMP�淶Ҫ��������������ҩƷ��������ͬ�����������������ҩƷ����������ҩƷ��GMP�淶����һЩϸ�ڵ�������ŷ��ͬ�岢��ίԱ����������ʽ�����ƶ���GMP�а䲼�ˡ������ƶ�����ҩƷ��GMP��ԭ���ָ�����롷��
����Ӣ��ҩƷ�������������淶��15.1�������й涨������ҽҩ��ƷӦ�����淶����ԭ�����������������ʼ���;������ijЩ���ò�Ʒ�����������Բ�ͬ������ͬһ��Ʒ���Ƽ�����������������ʵ��ġ�ijЩ���ò�Ʒ���綯��������������ҩ(��ҩԡҺ)��������ҩ����ֱ�ӵ�ͬ�ߣ����ڴ˹淶�����½ڹ��������������豸�Ľ�����ܲ������ã����dz�ֵ����ࡢ����ȫ��������Ҫ�ģ��Ծ����������ƴ����Ӻ���Ⱦ����
�����ҹ�̨��ʡ��������ҩ�������ڷ���������ҩƷ���������������б���֮ר���������������£�
ҩƷ�����������ر�涨֮�⣬ϵָҩ���̹���������������֮��ҩƷ����������ҩƷ����������������֮��������ҩƷ����
Ŀǰ������ֻ���й��ͰĴ����Ǹ��ݱ�����ʵ�������Ϊ��ҩ����ר���ƶ��ˡ���ҩ�������������淶����
2����չ�ſ� �ҹ�����ҩƷʵʩGMP����10�������ʷ��1982�꣬�й�ҽҩ��ҵ��˾�ƶ��ˡ�ҩƷ�������������淶(���и�)����1985���д�ˡ�ҩƷ�������������淶ʵʩָ�ϡ���1992���������䲼�ˡ�ҩƷ�������������淶����Ϊ��ϡ�ҩƷ�������������淶���İ䲼���й�ҽҩ��ҵ��˾��1992��ԡ�ҩƷ�������������淶ʵʩָ�ϡ��������������淢�С�1998����������ල�����ֶԡ�ҩƷ�������������淶����������֮������ˡ�ҩƷ�������������淶ʵʩָ�ϡ�(2001���)��
Ϊ�ƶ���ҩ��ҵ�Ľ�����չ����������ҵ�ij����ȶ���������֤�������彡�������������ҩ��Ʒ�����������������ҩ���������ӹ죬ũҵ����1989��䲼�ˡ���ҩ�������������淶(����)������������ҩ������ҵʵʩGMP������1994�귢���ˡ���ҩ�������������淶ʵʩϸ��(����)����
ũҵ���ļ�ũ����[1994]32�������ڷ�������ҩ�������������淶ʵʩϸ��(����)����֪ͨ���������涨����1995��7��1���𣬸����½�����ҩ������ҵ���뾭���Ҳ���֯��GMP���պϸ���ܷ�������ҩ��������֤�������������涨�����е�������ҵ���밴GMPҪ���ƶ��滮�������м������졣����2005��12��31��ǰδȡ�á�GMP�ϸ�֤������ҩ������ҵ��������������ҩ��������֤���������ٽ�����ҩ��������
1998�����ũҵ����28�����ķ����ġ���ҩ��������ʵʩϸ�ĵ����������涨���½����������Ľ�����ҩ������ҵ���������ũҵ���ƶ��ġ���ҩ�������������淶���涨��������ҩ������ҵ���ա���ҩ�������������淶���涨��Ҫ�����滮��������ʡ����������ֱϽ��ũҵ(����)��(��)���������ʵʩ����
�����꣬��ҩGMP��ʵʩ�ܵ�����������ҽ�����������ź���ҩ������ҵ�����ӣ�������ҵ�ƶ���ʵʩ��ҩGMP�Ĺ滮����ǿ����ҩ������ҵ��Ա����ѵ���ӿ��˶����������������豸�ĸ��첽������ĿǰΪֹ��ȫ������30�����ҩ������ҵͨ����ũҵ��GMP������ա�Ϊ�˼ӿ���ҩGMPʵʩ���̣�2001��ũҵ������������ҩGMP����ίԱ����������֯����ҩ�������������淶(����)������������2002��3�°䲼���°桶��ҩ�������������淶��(ũҵ��11����)��
��������ҩGMP������Ҫ���ݼ�����Ҫ��
���С���ҩGMP����Ϊ���ĺ�¼�����֣��������Ĺ�ʮ���¡���ʮ��������¼����������������ݡ�����Ҫ����Ϊ��
��һ�� ���� ˵���ƶ�����ҩGMP���ķ��������ǡ���ҩ������������ͬʱ��ȷ����ҩGMP������ҩ���������������Ļ�����
�ڶ��� ��������Ա �涨��ҵӦ�����������������������涨����ҵ����������Ա����������������������Ա�����ʣ��ϸ��ʸ���ѵҪ��
������ ��������ʩ �涨��ҵ�����������������֡�һ�����������ྻ�������ִ����������鼰������ʩ��Ҫ��
������ �豸 �涨��ҵ����߱�����������Ʒ����Ӧ�������ͼ����豸�����涨�豸�����ͼ����춨�ȷ����Ҫ��
������ ���� �����������ԭ�����ϰ�װ��������ʹ�ã��Լ�ԭ�����ϡ���װ�������Ʒ�Ĵ���ȷ����Ҫ��������ȷ�Ĺ涨��
������ ���� �涨��ҵ�ij�������������Ա������Ҫ��
������ ��֤ �涨��������ʩ���豸�Լ��������յ��辭��֤����Ͷ��������
�ڰ��� �ļ� �涨��ҵӦ�еĸ����ļ�������ݡ�������顢����������ӡˢ��������Ҫ��
�ھ��� �������� �涨�������ļ����ƶ����������̵Ŀ��ƺ�Ҫ��
��ʮ�� �������� �涨������������������ҩ������ҵ�еĵ�λ�Լ������������ŵĸ�����Ҫְ��
��ʮһ�� ��Ʒ�������ջ� �涨���й����۵ĸ������Ҫ���ص��Ƕ��۳��IJ�ƷӦ�п����ԣ�����ʱ������ȱ�ݵIJ�Ʒ��
��ʮ���� Ͷ���벻����Ӧ���� �涨��ҩ������ҵӦ������ҩ������Ӧ��챨���ƶȣ�����ҩ���ֲ�����Ӧ���������⼰��ȫ����Ӧ��ʱ�ռ����ϱ��йز��š�
��ʮ���� �Լ� �涨��ҩ������ҵӦ�ƶ��Լ칤��������Լ����ڣ���������֯�Լ졣
��ʮ���� ���� �ԡ���ҩGMP���漰�й�רҵ�������ע�⡣
��һ�� ʵʩ��ҩGMP��Ŀ�ĺ�����
һ��ʵʩ��ҩGMP���ҹ���ҩ��չʷ�ϵ���̱�
���й��������ھ�������ҽ������Ʒ������������20����60���֮ǰ������ҽ������Ʒ֮�⣬�������ν����ҩ����Ϊ��ҩ���档
��������ҵ�ķ�չ������ҩ���������ӡ�20����80��������ҹ���ҩ��ҵ���ڿ��ٷ�չʱ�ڣ���ҵ��������ҩƷ�ִ����������Ϊ�淶��ҩ��������Ӫ�����֤��Ʒ����������Ժ�Ⱥ��ˡ���ҩ��������������(1980��)�͡���ҩ����������(1987��)����ȷ�涨�˸�����ҩҩ����ҩ�칤��ְ��֮�� ��ʡ������ҩ��������ʡ����ҩ������������������ҹ���ҩ������ϵ���ĸ↑�������������ҹ���ֳҵ���ٷ�չ����ҩ��Ϊ��ֳҵ��֧�ֲ�ҵҲͬʱ���Ѹ�ͷ�չ���γ�����Ϊֹ2000�����ҩ������ҵ�����ֵ��200����Ԫ�Ķ�����ҵ�����ǣ�Ŀǰ�������ҩ������ҵ�ձ������Ա���ʲ�����������������ģС�����������͵����⣬����������������Ӧ�ִ�����ֳҵ������չ����Ҫ���ر��ǽ�������������ҩ���������������ҩ��ʹ���R�������ܵ�Ӱ�죬������ֳ��Ʒ����ҩ��������꣬������ڲ�Ʒ���˻����¼���������ɹ��ҵľ�����ʧ��ͬʱ����Ӱ���ҹ��Ĺ�����������Щ����ķ���������ȫ������ҩ��Ʒ�����ļ����ע���ڴ������£�ũҵ�����Ĵ������С���ԼGMP�����Ӹ����Ͻ����ҩ�������⡣ʵʩ��ҩGMP�Ա�֤��ҩ�������淶��ҩ����������ı������ã�������ҩ��ҵ������һ����ҵ������ͬʱ���ҹ���ҩ��ҵ��չʷ�ϵ�һ����̱���
��������ҩ�ں��������������ȷ����ʶ������GMP��ҩ���������ʵʩ��ҩGMP�Ļ��������㡣
�Դ�����ѧ���������﹩�Լ�ʳ���������Ϳ�ʼ������ҽ����ҩ���Ŵ�����ҩ��������ʶ���Ϊ���顢�㡢����������������Чȷ�У���������ʹ�÷��㣻���������۸���ˡ��ڽ�����������ҩ������ǿ��Ϊ����Ч�ԡ����ü�����ȫ��������Ȼ������Ч������Ϊ��λ��ͬʱǿ����������������Ϊ�������������侭��Ч��Ϊ��������ͷ��������ƴ����ѳ�����ͷ����ı�����ֵ����ô����ͷ����������������塣��������ȫ������Ȼͣ���ڶ����ƶ���İ�ȫ����Ϊ�����ƶ���Ķ�������С����Ϊ��ȫ��������Ϊ��ʹ�������ô���Чȷ�У����Ƴɱ��͵���ҩ���ǿ���ʹ�á�����������ֳҵ�ִ����ķ�չ����ҩ��ʹ���Ѵӵ�����Ԥ�����Ƽ�������չ����Ԥ�������Ƽ������ٽ�����������������ֳ��Ʒ��Ʒ�ʵȶ�ܵ�����Ϊһ�塣ҩ���ʹ�ã��Ӹ��嶯���ҩ��չ��Ⱥ���ҩ����ҩ��ʽ��ҩ��ļ���Ҳ��չ��ע�䡢�ڷ���Ƥ�����롢�������ӡ���ˮ�ȶ���;��������IJ�ͬ����������Բ�ͬ��ҩ���ҩ�������ж��г���������������Ʒ�ֵ����ӣ�������һ��ҩ��������ڲ�ͬ�Ķ��Ҳ������һ�ֶ���ʹ�ö���ҩ���ҩӦ����˾�ĸ��ӵı仯�������˶���ҩ�����ں���������ʶ���ִ�����ֳҵ����Ҫ��Ҳ�������õ�����ҩӦ���Ϊ����ȫ����Ч����һ���ȶ������㡢�������������Ѱ�����ȫ������Ϊ��λ��
(һ)��ҩ�İ�ȫ��
(1)����ҩ����İ�ȫ�ԣ�����Ҫ����һ��Ķ������ã��ر�Ӧע����ҩ���ڶ����Բ�Ʒ�ڵIJ������⣬����ҩ��������ⶾ��(�����»����°�����ͻ���)��
(2)����ҩ������ʹ���ߵİ�ȫ�ԡ�
(3)����ҩ����������ʹ�û����İ�ȫ�ԡ�
(4)����ֳ��Ʒ��ʳ���ߡ�ʹ���ߵİ�ȫ�ԡ�
����������ȫ�����ѴӶ���ҩ����İ�ȫ�ԣ�ת�Ƶ������లȫ�ԡ����Ƕ���ҩ����ȫ�����ĸ���ĸ���ת�ơ�һ����ҩ��ʹЧ���dz��ã����䰲ȫ�����ﲻ��Ҫ�������Խ�����ֹ������ʹ�á�
��������ҩ����Ч��
������ֳ������������ڶ̣���������ࡢ�����ʸߡ�����Ѹ�ٵ��ص㣬���Զ���ҩ����Ч��Ҫ���ر�ߣ�һ���������ҩӦ�߱���Ч����Ч����Ч����Ч���ص㡣���⣬��ҩ�ӵ����Ĺ���תΪ��ܣ����Զ���Ч�Ե�����Ҳ���ʮ�ָ��ӡ����磬ij��ҩ������ƹ�Ч�䲻���룬������ж����Ĵٽ��������ܣ�ij��ҩ������ֶ������ƹ�Ч���ѣ�������һ�ֶ���ȴ�нϺ���Ч���ȵȡ�
��������ҩ�ľ�һ��
������ҩ���ͼ���ҩ��ʽ�Ķ����ԣ�����ҩ��һ�Ե�Ҫ����������ҩҪ����ߡ������������Ӽ�������������ҩ��Ũ�Ƚϵͣ���ͬʱ�д�������ֵ����壬��ʹ��ǰ��Ҫ���ӵ�������ȥ�����Զ�ҩ��ľ�һ��Ҫ���ر�ߣ������ڲ�Ʒ����ʱ�Ǿ�һ�ģ�ͬʱ�������桢���䡢�������ӵ��ټӹ�ʱ��Ҫ��֤ҩ��ľ�һ�ԡ�
(��)��ҩ���ȶ���
��ҩ���ȶ��Բ���Ҫ�����������ȶ����нϳ�����Ч�ڣ�ͬʱҲҪ����ʹ���е��ȶ��ԡ����磬��Щҩ���Ƴ���Һ���������ȶ��ģ�����ˮ�Ƴ���ˮ����Ӧ���ó������ֲ㣬����Ϊ���ȶ�����Щ����ҩ�����Ӽ������������ټӹ��ɿ����ϣ�Ҫ��ҩ���ܾ���ѹ�ƿ�������ʱ���¡���ѹ����ʪ�Ȼ���������Ȼ�����ȶ���
���壩��ҩ�ķ�����
����ǰ����ҩ�ĸ�ҩ��ʽ���ѴӸ��嶯���ҩ�ı�ΪȺ�嶯���ҩ����һȺ����ͬʱ��ҩԤ����ٽ���������һȺ�����У�ֻҪ��һ��������ֲ�֢��ͬȺ���Tʹ��δ���ֲ�֢Ҳ��ͬʱ��ҩ��ͬʱ���ִ�������ֳҵ��ֳ��ģ�ܴ�����һ����ֳ��ͬʱ������ͷ����һ��ʮ��ͷ�����ҩ��ҩ�ķ������ڴ�ʱ�Ե�ʮ�ֵ���Ҫ��
��������ҩ�ľ�����
������ֳҵ��Ҫ���������ijɱ���������������ҩ��Ȼ�����ӳɱ������پ���Ч�档��������ɱ����ĸ������Ҫ������ҩ�ɱ�����Ҫ������ȣ���ÿǧ�������������ֳ��Ʒ�ı��������ȵȡ�����һ��Ч���ܺõ�ҩ��ò����ƹ�Ӧ�ã��ɱ�������һ������Ҫ�����ء�
���ڶ���ҩ��˸߱���Ҫ���ڹ����ϣ���ҩ����������ں��Ѳ��������ڡ�����ϸ�������������������������ת��Ϊ������������������ν���������������ĺ���ӦΪ����ʹ�����߳е���ȫ����������Ч�ķ��ա�����������ҩ�������ߡ��ĸ������ҩ��Ϊ�㷺������ָ��ҩ�Ķ����������ҩ��ʹ���ߣ���ֳ��Ʒ��ʳ�ã�ʹ�ã��ߡ����ԣ�һ��������۷��ϲ�Ʒ����������ҩ��Ʒ�������Dz������á�������������ԭ���Ƕ��ģ��������䷽����������Ͳ����ˣ���ɱ�����ȫ�Դ������⣬�ȵȡ���ҩ�����ɡ������ԡ�ת��Ϊ�������ԡ�����ʹ�������������������ӽ����淶��������Ӫ��Ϊת�Ƶ�����ع�ע�������ߡ�����ǰ�ҹ��Ѽ�����ó��֯��Ҫ���й���ó�ף�Ҫʹ�ҹ�����ֳ��Ʒ��������г��͵��Ͽɹ��������ѭ�ġ��ϸ��������ۡ������ҹ���صķ������粻���롰�������������ĸ��û��������ŵ�����ڹ����ϵò���������Ȩ�档���ҹ����÷�չ���������г�תΪ���г�������������Թ�ʣ����Դ�˷��ѳ�Ϊ���ÿɳ�����չ���ϰ����ҹ�����ֳҵ����֧�ֲ�ҵ��ҩ��ҵ����ͬ���������Ŀǰ��ҩ������ˮƽ���ظ����úϸ��ԭ���������ӵ���ҩ��Ʒ��������г������ȵ��ѳ�Ϊ��ҩ��ҵ������չ�ľ���������Щ���ر�Ȼʹ�ҹ���ҩ��ҵ������������ת��Ϊ�����ͣ�������Чͬ������֮·������ҩ��ҵ�ɳ�����չ�ı���֮·��
���⣬��ҩ��Ʒ�ԡ�����ϸ�Ϊԭ��ı��Ѳ�����Ӧ��ֳҵ��չ��������Ϊ�ԡ�����ϸ���Ϊ�����Լ�������ϸ�ԭ�����Ƴɵij�Ʒ������ҩ�������ǰ�ע���������϶��ģ���ҩ��Ʒ��ԭ�����ʳ������������Ⱦʱ��һ����������������δ����ԭ�������е�������Ŀ��������ȾƷ������Ҫ������ij����ijһ���֣����������������������ʱδ�ܳ鵽��Ⱦ�IJ��֣�����Ʒ������������ϸ�Ҳ���ܷ�ӳ��Ʒ��ȫ��������ʵ�������ͬʱ����ҩ�������̵ĸ������ؾ�������ɳ���ȱ�������Եĺ���������ƻ������������ƣ����������۶����ڲ��ϸ��Ʒ��©��ķ��ա���ˣ���������������۷�������������������֤������Ʒ����������ҩ��ƷӦ�ӹ�ȥ������ϸɳ������Ĵ�ͳ�������ı�Ϊ��ҩ��Ʒ���뾭�����������Ÿ�����˳���������¼���������¼���پ�����Ʒ�Ƿš���������������ҩ��Ʒ��GMP��������Ӧ����Ϊ��
����Ʒ�����̻��������涨��DZ�ڵ�������Ҫ�����������������ܺ͡���
�������˵����ҩ��Ʒ�����������˴��г��о������ƿ�����ԭ�ϲɹ������������顢���ۡ��ۺ��������Ӧ���ռ�����Ʒ�ջص�һϵ�еĹ��̣����յ�Ŀ����Ϊ��������ֳҵ������
ͨ������ҩ�����ں��������������ȷ��ʶ������ٽ��ҹ���ҩ��ҵ��һ���µ�����ϻ�ô����䵽�ʱ���ش�չ��Ҫʹ��ҩ�����ﵽ�����ִ�����ֳҵ����Ҫ���ͱ�����ִ����ĸ߿Ƽ���������ҩ��ҵ�У�Ŭ���������͡���ȫ����Ч������ҩ�����ϵ������ҩ��������ʹ֮�ﵽGMP��ˮƽ����ȫ��ҩ���ƻ��Ĺ�����ʹ��ҩ��������Ӫ��ʹ��������������г����õķ��ƹ����������ʽӹ죬ʹ��ҩ������Ϊ�ִ�����ֳҵ������չ�������ı��ϡ�
����ʵʩ��ҩGMP����ҵ�Ļ��;����������
��ҵ�Ļ���һ������Ϊ��������ҵ����Ϊ���ģ���ʵ����ҵ�������廯ΪĿ������˹�����ѧ�����ֹ�����ѧǡǡ����ҩGMP����˼���һ�����֡���ҵ���������м�������Ӫ�������ȷ�������ݣ����зḻ���Ļ��ں�����ҵ�Ļ�������Ա������ʶ��̬���棬���������Ϊ��ֵȡ���¹淶��ϰ�����ǡ�Ⱥ������(��������ҩGMPҪ�ص�����)����ҵ�Ļ������������ʷ��棬�������ݡ���ò(��������ҩGMPҪ�ص�Ӳ��)�����������ڲ�Ʒ�������ϡ�
��ҵ���Ļ���������Ϊ��ҵ�ľ�����ҵ��������ҵ�ڳ��ھ�Ӫ���������γɣ����쵼���ܽᳫ����������ҵ���ظ��Ժͼ������ã���Ϊ��ҵԱ������ͬ������ͽ��ܣ���Ϊ��ҵԱ����������ʶ�������Ϊ����ҵ�������ھ��е����ܡ����۹��ܡ��������ܣ����Ҷ�����з��书�ܣ�����Э����������ˡ���������ҵ����ҵ�����������ϵ������ҵ��������ҵ�Ļ��ĺ��ģ�����ҵԱ�����е�Ⱥ����ʶ���ŶӾ���
����ҵ�ﵽһ����ҵ�Ļ�ˮƽ����ҵ����������������ҩGMP��ʵʩ����ʱ����ҩGMP�ĸ���涨���Ѳ��Ƕ�Ա����һ����������������Ϊ��ҵÿһ��Ա���Ծ�����Ϊ��
�ڶ��� ȫ�桢��ȷѧϰ�����⡶��ҩGMP��
�� ����ҩGMP������ҩ���������۵ȷ���������ȫ�桢��ϸ������Ĺ涨�����ڳ�ѧ����ԼGMP������Ա������ڶิ�ӵġ�רҵ�Լ�ǿ�����ģ������е�ѧϰ�����֡������⡢�Dz�ס����������һЩѧϰ��������
���ݶ�����ʵʩ��ҩGMP�ľ��飬������ΪֻҪץס����ҩGMP���ľ���ʵ�ʣ���ᡶ��ҩGMP���Ļ���Ҫ�죬�������ʵ��������˼�����̿����У���ôѧϰ�ϵ����ѣ�����ӭ�ж��⡣
һ������ҩGMP���ij����㣬���ڶ���ҩ�����ں�������
�����һ���������ģ���ҩ�����������Ѳ�����ͣ�����Ƿ����������������Ҫ���������ִ�����ֳҵ����Ҫ�ġ���ȫ��Ч����ҩ������ҩ�����Ŀ�����ȫ���̵ġ���ҩ��ҵӦ��ŵ�����ƿ��������������顢���ۡ������ȫ��λ������������Ҫ����һЩ��������GMP����Ʒ���������ϸ����Ĵ�����
��������ҩGMP����ʵʩӦ�����ȫ��Ա��������Ϊ����
��ҩ������ҵGMP�ĸ��죬��������ҵȫ��Ա�������GMP���졣��ҵȫ��Ա����ʵʩ����ҩGMP������������������û��ȫ��Ա���ԡ���ҩGMP����ȫ�桢��ȷ�����⣬�Ծ���ִ�С���ô�����ٺõ�Ӳ����������һ�н���ͽ�͵ġ�
������ҩ������ҵ��������������������ʩ���豸��Ӳ������ʵʩ����ҩGMP��������̨��
û����ЩӲ�������ı�֤��һ�й�����ʩ�������֡���ͬʱҲӦ������ҩGMP��Ӳ����һ������ĸ����Ҫ���������ġ���Ӳ��Ӳ���������ǽ���������һ���ྻ��������һ̨�Ƚ��豸���ǴﵽGMP��Ҫ��
�ġ���ҩ������ҵ�ĸ��������������ҵ��������������ʵʩ����ҩGMP�������籾��
һ������������������Ƚ�������̨���ϣ�û��һ����ɫ�����籾�������ݺá���ҩGMP����̨��Ϸ���������ҩGMP�ĸ���ӵĹ���Ҫ������ʹһЩ��ҩ��ҵ�е������֡���ͨ������������Щ����Ҫ���У��������������߹ᴩ��ȫ������ҩGM P����
(һ)��������Ҫ��ֹ��Ⱦ
����Ⱦ����ԭ��Ϊ��ָԭ���ϻ��Ʒ�������������������ӡ�������������������ԭ��Ϊ��ָһ�ֻ�һ����������ԭ���ϻ��Ʒ�����Ʒ���ȵ�ԭ���ϻ��Ʒ��������׳�����ҩ�����������ʵ����������������Ҳ�ɿ�����һ������Ⱦ����������Ⱦ���������и���������⣺�����������ۡ����ӡ����졢ʧ�桢��©���������ɲ�Ʒ���������⣬������Ϊ�DZ�����Ⱦ���ˡ���ϸѧϰ����ҩGMP��������������ƪ����ҩGMP������������η�ֹ��Ʒ����Ⱦ�����⡣GMP����ҩ�Ĺ���������Ҫ��������������������Ա(�ྻ����Ϊ)����ʩ(�豸������)��ԭ�����ϡ��������ա���װ���ִ������ۡ����估�����ƶȵȷ��棬��ֹ����Ⱦ���IJ�����
�ڷ�ֹ��Ʒ����Ⱦ��ͬʱ��Ҳ���ֹ��ҩ�������Ի�������Ⱦ����ֹ��������Ա����Ҳ������ҩ����ͬʱӦ���ǵ����Ի�������Ա�İ�ȫ�ԡ�
(��)���������Ҫ��֤
��֤��ԭ��Ϊ����֤���κγ����������̡��豸�����ϡ����ϵͳȷʵ�ܵ���Ԥ�ڽ�������ļ�֤�����ж���
��֤�����þ�����������Ϊ��ʵ����Ϊ������֤��ϵͳʵʩ�ṩ�������ݣ��Ӷ�ʹ������֤�����ι̵�ʵ����������ҩGMP��ʵʩ�����ڹ㷺��֤��������֤(ǰ����֤��ͬ����֤������֤����Ŀ����֤)�н����������
ͨƪ����ҩGMP�������۵ĸ��ֲ��ԡ����顢���顢���ˡ������ռ������ȵȣ�ʵ�ʶ�����֤��һ���ֶΡ�
����ҩGMP���涨������֤�ķ�Χ����������(����)��֤����ʩ(�豸)��֤��ԭ����������֤��������֤�����鷽����֤��������֤�������춨����Ʒ���顣�ȵȡ�
������֤����������⣬�Ϳ���ʶ��������Ա����ѵ����Ҳ������Ϊ����Ա������֤���� ��Щ�����ƶȵ����ƶ�����ִ��������������ִ������ʵ��Ҳ����������֤���Ĺ��̡�
���ԡ���ҩGMP��������������һ����(�)��(ԭ���ϡ��豸��)��Ҫ�ʸ�Ϊʲô?��ô��?�ò���?�в���?����ͨ����֤��������ʹ�á�
(��)����һ�������ƶ�(����SOPҲ������Ϊ�ƶ� ��һ����ʽ)
����ҩGMP�������ĺ����������ƶ��ƶȺ��ϸ�ִ���ƶȡ��������¼��㣺
(1)��һ���(��)�ͱ�����һ���ƶȣ�
(2)���ƶȾͱ���ִ�С�
(3)��ִ�оͱ����¼��
(4)�м�¼��Ҫ���ۺ�(���������)��
(5)���ۺ�(���������)�������(�Ľ�����)��
(6)һ���ƶȱ�����ִ�У��Ծ����أ���֮�Ժ㡣
Ҫ������һ���Ǻ����ѵģ�����ǡǡ�ǿ��������ġ���Ϊ�ƶ���������ƶȵĹ��̾����ܽ�������Ϊ��������Ϊ�Ĺ��̡�ִ�и�������ƶȾ��Ƿ�������Ա����������Ϊ����������Ա���IJ�����Ϊ������ʹ��������ƶ�Ϊȫ��Ա���Ծ����ء�
������ ʵʩ����ҩGMP������״���Բ�
��1989��ũҵ���䷢����ҩ�������������淶(����)����1994��ũҵ���䷢����ҩ�������������淶ʵʩϸ��(����)��������������ҩ�������ż�ȫ����ҩ��ҵ�����ʵʩ����ҩGMP��������һ���ϳ������⡢��ʶ���̡���������������ֳҵ�ķ�չ����ҩ����Ҫ��Խ��Խ�ߣ��ر����ҹ�����WTO�����ƣ�ʹ�ҹ��ľ��÷�չ��ȫ������ʽӹ��Ҫ��Խ��Խ���У�ͬʱ����ũҵ���涨��ȫ����ҩ��ҵ������2005��12��31��֮ǰ�ﵽ����ҩGMP��Ҫ�������Խ��Խ������ˣ��Ӵ����С���ҩGMP�������������ڱ��С��̲��ݻ���������ʵʩ����ҩGMP�������Ƴ��������˿�ϲ�ľ��档������ҩ�������������ҩ��ҵ�ӽ���ʵʩ����ҩGMP���IJ����������ƶ�ʵʩ����ҩGMP���Ĺ滮���ٰ��������ҩGMP����ѵ�࣬������2005���ǰ�ﵽGMP����
������ȫ����ҩ��ҵ���С���ҩGMP���Ĺ�����չ�Dz�ƽ��ġ���������ҩ������ҵ����������ҩ�����������쵼�˶���ҩ��ҵȫ��ʵʩ��ҩGMP���Ĵ����ǣ��еı�����̬�ȣ��еİ���������������������ҩ��ҵ���쵼�˻�����ذ�ʵʩ����ҩGMP���뷢չ��ҩ�����������ҩ��������������һ�������Щ�ִ���̬�Ⱥ۵��ͬ־Ҫ��������������һ��������Ҳ�����ѵ���ʶ������ȫ����ҩ��ҵ���С���ҩGMP��ʵʩ���������ٵ����ѡ�����ҩ������ҵ���������������ʽ�ȱ����ʵʩ����ҩGMP������ʱ����������أ����в�����ҵ�������ڲ����Ʋ�˳���������ѵȵȡ�Ϊ��ʹ��ҩ��ҵ��ũҵ���涨�������ڴﵽ����ҩGMP�����������ȡ���µĶԲߣ�
һ��������չ���ƽ������ᶨʵʩ��ҩGMP�ľ���
�ִ�����ֳҵ�ķ�չ���������������Ƕ���ֳ��Ʒ��������طḻ�������������Ҷ����ȫ������������ʾ����ش����塣��ֳ��Ʒ�ij��ڲ����ǻ�ȡ��㣬�����˾���Ч�棬����Ҫ��������ҹ��ڹ����ϵľ��õ�λ�����нϴ������Ӱ�졣���ǣ�����ķ�չ�����������������ġ���������չ��һ���̶ȣ��г����ֹ��������ʱ��Ȼ��������������۸�����չ�������ľ�����������ֳ��Ʒ�г����Ѵӵ�һ����������Ӧ���۸��������չ��Ҫ�����ṩ��ȫ�ġ���ɫ�ġ���ɫ�ġ���ζ����ֳ��Ʒ���ҹ���ʡ����½������ũ��Ʒ��ȫ������������֤�ƶȡ�����ֳ��Ʒ����֤��ͬ��ҩGMPʵʩһ����Ҫ�ල�����ֳ��Ʒ������ȫ���̣����оͰ�������ֳ�����У�ʹ�õ�Ԥ�������ơ�����������ҩ��Ʒ�Ƿ���Ϲ涨���ṩ��Щ��ҩ��Ʒ����ҵ�Ƿ�ͨ����ҩGMP��
���ԣ�ʵʩ��ҩGMP�������������˴������Ϊ������ҩ�������ŵ�����������Ϊ���������������������������Ϊǡǡ��һ����ȷ���г�������������ҩ������ҵͨ��ʵʩ��ҩGMP��ȥ�μӸ�Ʒλ����ҩ�г������������ȥռ���Ʒλ����ҩ�г�����Щ����α����ҩ�������ͼۡ��ؿ۵Ȳ�������������ҩ������ҵ�����ղ����DZ���������ҩ��������֤�������dz���ᱻ�г�����̭��
�������롢�ռ���չ����ҩGMP������ѵ����������ѧϰ����ҩGMP���е�������
����ҩGMP)�䲼����ѧ�����塢��ҵЭ�ᡢʡ����ҩ���������Լ�����ҩ������ҵ�������ؾٰ������ҩGMP����ѵ�࣬�����ཻ��ѧϰ�����������֯�������죬�����ר�ҽ��Ρ�������û��һ�����õġ���ҩGMP��ѵ�̲ġ���û���ҵ�ǡ������ѵ������ʹ������ѵ��������������ʽ���±����룬��Щ��ѵ��ʹѧԱ����ҩGMP�����������������е�ͬ־�ι���һЩ�����ҵ�����������ҵ��������������������ס�ˣ���ΪGMP���Ǻã�����ѧ���������е�ͬ־�ּ�Ƭ�����Ϊ��ʵʩGMP���ǻ�Ǯ��һ���ྻ�ij��������˰�æ��һ���ƶ�������Щͬ־�ɴ�������ѧ����Ϳ����ѧ��й������
ʵʩ����ҩGMP�������Ľ����ԣ����ȱ����ڡ���ҩGMP����ѵ�����Ľ����ԡ����뾡����֯��дһ���ʺ��й���ҩ����ʵ�ʵģ�������ҩ������ҵ��Ա������Ҫ�ģ�ͨ�ס�ʵ�á��ɲ�����ǿ�ġ���ҩGMP��ѵ�̲ġ������뾡������һ��ʵʩ��ҩGMP�ļ����Ǹɡ����롢�ռ��ؿ�չ����ҩGMP������ѵ������ʹȫ����ҩ��ҵ��ͬ־��ͨ����ѵѧϰ��ȫ����ʶ��������������ǿ���ģ������ж�����ȡ���մﵽ��ҩGMP�껴��
����ʵʩ��ҩGMP��Ҫ��������а��
ʵʩ��ҩGMP����������Ҫ������ҵ������Ŭ�������������ҩ�������������ƶ������֡�Э���ȹ�������ʱ�ƹ�ʵʩ��ҩGMP���Ƚ����飬��֯��ҩ������ҵ���ﻥѧ��ͬʱҪ�Ӵ�������α����ҩ���淶��ҩ�г��Ĺ����������ҩ��ҵ��������������ٻ����������ʱȲ����������IJ�����״̬��������ҩ��������Ҫ�˷��ط��������壬�����������棬����ȫ�ֹ�����ִ�С���ҩ����������������������ҩ�����ķ�����ִ�С��л�������ҩ�䡷�ȸ�����ҩ��������
����������ֻҪȫ����ҩ��ҵ��ȫ��ͬ־����ȷ��ʶ�������ж���ʵʩ��ҩGMP��Ŀ�궨�����ڴﵽ��
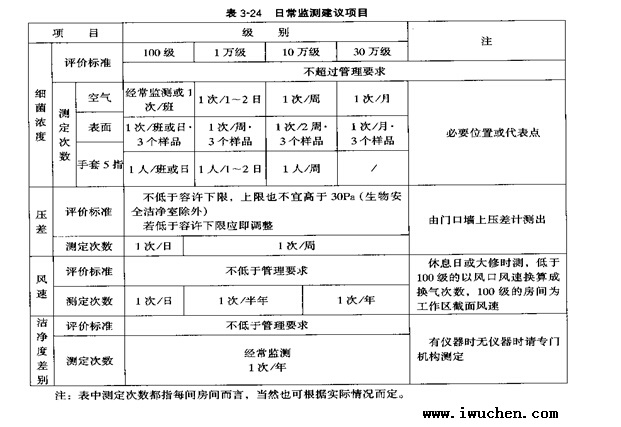
|
�ڶ��� ��������Ա |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
�� |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
���� ��ҩ������ҵӦ������ȫ����֯����������Ӧ��ҩGMP��Ҫ���ִ�������ҵ��Ӫս�ԡ�����ҩ�������������淶����ȷ�涨������ҩ������ҵӦ�����������������������������������Աְ��Ӧ��ȷ�����䱸һ������������ҩ��������Ӧ�ľ���רҵ֪ʶ����������Ĺ�����Ա�ͼ�����Ա��������ҩ�����������Ÿ����˺������������Ÿ����˾�Ӧ��רְ��Ա���Σ������û�����Ρ���������������ԱӦ��ʡ����ҩ�������ѵ�������˺ϸ���֤�ϸڡ��������鸺���˵������ͱ��Ӧ��ʡ����ҩ������������� ��һ�� ���� һ���ִ�������ҩ������ҵ����֯������ʵ������������ҵ�Ĺ���ģʽ �ڱ�֤��Ʒ��������������У�����ģʽ����Ϊ�����Ծ��Ӱ����������Ҫ�����ء�һ����ȫ����֯���������Ը�Ч��֯�ͷ���ȫ��ҵ��ְ����DZ�ܣ������Э������ٽ��Լ�������Ҫ�ؼල�ƶȣ�����ȵص���ȫ��ҵ�����ţ�����ʹ������ҵ�����л����õ���������ӪЧ�档 ����ij��ҩ��ҵ��������ͼʾ ��ҩ������ҵ�ڵ���֯�����м������в��ŵĹ�������Բ�Ʒ������Ӱ�����һ����ְ���ֶ�����ֱ��Ӱ���������йز��ŵ�����ְ��˵�����£� 1���о��������� �о�����������Ҫ�����Ʒ������������о��� (1)�����г�������·����ȫ����Ч�����á����ڱ���ҵ�����ġ���ʹ��ҵ��Ч���²�Ʒ�� �ټ�����ơ�ҩ���������ٴ����鼰��Ʒ�ȶ�������ȷ��������췽���о��� ����֯��д�걨ҩ�����������ϵȡ� (2)��չ����ҵ�������IJ�Ʒ���ոĽ���������ߵ��о������� 2�����̹������� ��Ҫ�����Ʒ�����ĸ��������� (1)��������ʩ���豸������(�DZ�)�����ļ��ı�д������ʵʩ�� (2)��������ʩ���豸������(�DZ�)��װ�����ԡ���֤��ά�ޱ������ճ�������������֤�����������������������С� (3)�������ϴ��������� 3����Ӧ���� ��Ҫ���������������ԭ��������װ���ϵ���������������֤�������������� (1)ͨ��������ƣ�ѡ�����Ҫ��Ĺ�Ӧ�̡� (2)��ʱ��֯���Ϲ�Ӧ�������ֱ������������ (3)������������ա����������ڵ������� (4)���ϸ����ϵĴ����� 4�������������� (1)�������������ļ��ı�д������ʵʩ�� (2)�����ƶ������ƻ����´�����ָ� (3)�����������������ļ��ı�д������ʵʩ�� (4)�Բ�Ʒ���졢���չ�̡���������̡���λ��������������̵�ִ��������мල������ (5)������������еļ������⡣ (6)�����豸��֤����������������֤�� (7)����������������ָ���ͳ�ƺ��������� 5�������������� �����������ŵ�ְ�������ҩGMP���ѹ涨�ģ���Ӧ�������������ļ��ı�д������ʵʩ���Լ�����������������ļ��ı�д������ 6�����۹������� ���۹������Ų�������һ����ƷӪ�����š�����ҩGMP�Ĺ��������Ʒ��������������������ͻ�����Ҫ���������۹������Ż��������г����С��ۺ�����Լ��������������ر����������ǹ��ڴ���ҩ��������Ļ��ڡ�����һЩ����������λ�����ϼӹ���λ����ҩ��Ӫ��λ��������ҽ��רҵˮƽ���ߣ��dz���Ҫ��ҩ������ҵ��ü�����������ָ����ȷ��������ʹ����ҩ��ͬʱ����Ӧ�����û����ʡ�����Ͷ�ߴ�����������Ӧ���ռ������鴦�����û��˻������ȹ�����ͬʱӦ���ռ������������⼰ʱ���������ŷ�ӳ�� 7���鱨��Ϣ���� Ӧ��ʱ�ռ��������²�Ʒ���¼�����չ����Ϣ��Ϊ����ҵ�����²�Ʒ��������в�Ʒ����ˮƽ�����ͳɱ�����������ȷ����ṩ�����鱨��Ϣ�ķ��� 8��������ѵ���� �����²�������£����ְ�����ϸڼ�����ѵ����ҩGMP��ѵ�ȹ�������Ҫʱ��Ӧ��֯ѡ�ɼ�����Ա���ѧϰ������ר������ҵ��ר�ⱨ��ȡ� 9�����²��� (1)���ݡ���ҩGMP����Ա������ְҪ������Ƹ��ѡ�Ρ����ø�����Ա������һЩ������˲�Ҫ���е����������¡���γ�ַ������ǵĴ�������Ϊ��ҵ�ķ�չ�������²���Ӧ���ܴ�����Ρ� (2)Ӧ�������������Ȳ���Эͬ����Ա����ѵ�ƻ�����֯ʵʩ����顢���ˡ� (3)����Ա�������֯����������ְ������������ 10���������� (1)��������������������������������P����������Ĵ��������� (2)��������ҡ���ϴ�����ϴ�������¡�ñЬ�����ú���ϴ�� (3)������ҵ������ְ���ճ�������������ڱ��Ϲ����� 11�������� �������ճ��������⣬��Ӧ���������ʽ�֧����������������Ӧ�Ȳ���Ϊ����������뿪չ����Ŀ����Ӧ����йز������������������ɱ���ͳ�Ʒ��������� �����оٵĻ�������ģʽ�Լ�����ְ�ܣ�����ҩ������ҵ���Ը��ݱ���ҵʵ������ʵ����������á�
�ڶ��� ��Ա һ����Ա�䱸����Ҫ�� ������Ҫ���У��˵����ص�һ��һ�й����벻���ˣ���Ա����ˮƽ�ߵͣ���ʵʩ��ҩGMP��������Ե����á�����۵��������Ϻ�������������ǹ�����ҩ������ҵ����ʵ״���ǣ��ձ����һ���Ƚ����ص���Ա���ʲ��ߵ����⡣��Ҫ��������һЩ���棺 1��������� �ҹ�����ҵ�ڸĸ↑��������ȡ��������Ŀ�ķ�չ�����Ʒ������Ʒ�֡����������������������ǰ��λ������ҵ������ģʽ�ѴӴ�ͳ��ͥʽ�ġ�רҵ������ʽ����չΪ��Լ���������ӡ���һ����ִ������ģ����ֳ���ҹ�����WTO�Ժ���ҽ���ߣ��������Ʒҩ������ȹ�������˸��ߵ�Ҫ�������������£����ڽ�2000����ҩ������ҵ�дֻ�����һ���ϵ�ˮƽ��״̬��һЩ��ҵ���쵼��������С��ģ������ʽ����������ʵʩ��ҩGMP���ֹ���̬�ȣ������Բ��ߡ���Ϊ����ҵ֧�ֲ�ҵ����ҩ��ҵ����״̬��������ҵѸ�ͷ�չ��������ʮ�ֲ���Ӧ�ġ� 2��������� ���ڴ���ҩ������ҵ�ļ�����Ա�Ǵ���ҽ������רҵ����������ҩ��רҵ���и���ҩ�����ġ���ҩ���������ҩѧ����ѧ��������ѧ���̡����ﻯѧ��רҵ����Ա��ԽϽ�ȱ��������ҩ�����漰��ѧ�ϳɡ������������ﻯѧ��������Ʒ����ҩ�ȶ���ԭ�ϡ����ּ��ͣ�רҵ�Ժ�ǿ�����ǽ�����һ����רҵ�˲ż�����Ӧ�ġ�רҵ�˲ŵ�ȱ������ʵʩ��ҩGMP�����������ѡ� 3���Ļ�ˮƽ��� ���ڴ���ҩ������ҵ������������һ�ߵĹ����Ļ�ˮƽƫ�ͣ������еIJ��������Ļ�ˮƽ���е�δ��������ѵ���ϸڲ����� ������ҩGMP����ҩ������ҵ��Ա���ʵĻ���Ҫ��(��2��1) ��2��1 ��ҩGMP����Ա���ʵĻ���Ҫ��
���ݡ���ҩGMP������ҩ������ҵ��Ա���ʵĻ���Ҫ���Ը���Ϊ�� 1�� �Ļ��̶� �Ļ�ˮƽ��רҵ�����Ļ������粻�߱���ר�����Ļ��̶ȣ���ҵ�����˼������Ÿ����˾Ͳ�����Ӧ�ִ�����������ҩGMP������Ҫ���粻�߱��������ϵ��Ļ��̶ȣ�����λ����Ա�������ܽ��������ϸڼ�����ѵ����������ִ�и�������ָ����ԡ���ҩGMP����ȷ�涨ֱ������������Ա�Լ�����������Ա����߱����������Ļ��̶ȣ�����רҵ������ѵ�����ϸڡ������Ļ��̶���Ա����ֱ�ӽӴ��������ո�λ�����ɵ��θ������������� 2��רҵ֪ʶ ����ҩGMP���涨��ҩ������ҵ�������������������ĸ�����(��ͨ����ָ��ҵ���ܼ���ҵ��ij���)�������������ŵĸ������Լ������������ŵĸ�����Ӧ�߱���ר�����Ļ��̶��Լ�ҩѧ����ҽ�����רҵ�������רҵ��ϵָ��������ѧ��������������ﻯѧ����ѧ���̵�רҵ��������ҩ���������רҵ�ԾͶ���Щ�����˵�רҵ֪ʶҪ��ͺܸߣ�������ʤ���쵼��������ʹ��ҵ��ý�һ����չ����̸����ʵʩ��ҩGMP�� 3��ʵ������ ����ҩGMP���涨��ҩ������ҵ�������������������ĸ����ˣ��������������Լ������������ŵĸ����˻�Ӧ�߱���ҩ����������������ʵ���������ȷ�жϴ�������������ʵ�������������������ҩ������רҵ�Ժͼ����ϵĸ����ԣ���ҩ�����ĸ߱���Ҫ���Լ���ҩ���ۡ�ʹ���г��ָ������⣬��Ҫ��Щ�������зḻ��ʵ�����飬���������ʱ���ָ��ֵ���������ȷ�жϺ�������ȷ�Ĵ����� 4������ˮƽ ��ҩ��һ��������Ʒ����ֱ�ӹ�ϵ�����ݵȶ���Ľ��������չ�ϵ������İ�ȫ��������ҩ���������ۼ�ʹ�ö�Ӧ���Ϲ����й��������漰��������Ĺ涨��Ŀǰ��һ������ҩ��ҵ��Ա�Թ���Ժ�䷢�ġ���ҩ�����������йصķ����Լ����л�������ҩ�䡷����ҩ���ұ���Ȼ֪֮���٣�����һ����֪����������Ǿ��Բ������̵ġ�����������һ������������˻�Ϸ���������Ӫ��ʹ����ҩ��������������ҩGMP��ͬʱ�������ǿ��ҩ�������������ѵ������ 5����֯���� ʵʩ��ҩGMP�������Ǽ�ǿ��ҵ�ĸ���������������ԣ�һ���ִ����ġ�ʵʩ��ҩGMP����ҩ������ҵ��������Ҫרҵ������ͨ���˲ţ�����Ҫһ����֯����ǿ�Ĺ����˲š� ��������Ա����Ҫ�����εķ��� 1������ ��ʵʩ��ҩGMP�Ĺ����У���ᵽ����ҩGMP������Ա���ʵ�Ҫ���и����εĺ��塣 ��Ա�����ʲ���ȡ�������Ļ�������רҵ����ʵ������ȡ���������ʵ����������ᱳ���������ߵ��ۺϣ�������һ���˵IJ�ͬ���������һ�����Ƿ������õ�ְҵ���£���Ϊ��ҩ��ҵ�����ľ����Լ�������ҵ��������Ӧ�ԣ�����ҵ��ͬ���ǵĻ���Э���ԡ������ԡ���������һ�дﵽ������ϵ�ʱ������ʾ������˵�Խ�������������ջ�Ϊ��ҵ�������Ĺ��ס� 2����Ա�ķֲ�� (1)����ָ�Ӳ㡪��(���»�)�������ܹ���ʦ������ҵ�ĺ����쵼�ˡ� �ٳ�������һ����ѧͷ�Ժ;��÷�����������һ���ִ�����ҵ�Ĺ����˲ţ�����Ӧ�г����õ�ʵս�ߺ�ָ���ߡ����д�ר�����Ļ�ˮƽ��5��������ҵ��Ӫ�������飬��Ϥ��ҩ��������;��÷��棬���ھ�Ӫ��������һ������֯�쵼������������ϵȺ�ڣ�������������ͼ�ഴҵ��ʵ�ɾ����긻��ǿ�����彡������ֵ�һ�߹����� ���ܹ���ʦ���ܹ���ѧרҵ������������ҩ��������������ʵ�����飬��Ϥ�������ռ��²�Ʒ�����о�����Ϥ��ҩGMP�������������Ա�� �������ҵ�쵼�����ʣ����õ÷ַ������ۣ�������2��2���У��ɹ��ο��� ��2��2 ������ҵ���쵼���ʵ����۱�
��������г����õķ�չ��ʹ��ҩ������ҵ���ڼ��Ҿ���������һ����ҵ����ָ�Ӳ�ľ�����ȷ���ϵ�������ҵ�����漰��չ�� ��2����֯ʵʩ�㡪�����������ˡ����������ˡ����������Ρ�����ҵ������������ ��һ����ε���Ա����Ȼ����Ҫ����ָ�Ӳ���Ա�ĺ�۵�����������ȴ��������ҵ�ĹǸɣ�������һ�ߵĴ����ˡ�Ҫ�����ʮ�ַḻ��ʵ�����鼰�ܳ�����֯����������ʱȷ��ȫ��������ָ�Ӳ��ս����ͼ�����һ��������Ĺ�������ʹ����ָ�Ӳ�ľ���ʮ��ȷ��û����һ����Ա�ļ���᳹�����ս���ȡ��Ԥ�ڵ�Ч���� ��3������ִ�в㡪�������������鳤������Ҫ��λ�IJ�����Ա������ҵ�ij�������ߡ� ��һ��ε���Ա������ʮ�������IJ��������Լ��ɹ�ľ�ҵ�������Ǿ���ҵҵ����ÿһ�����Ĺ�����������Ȼ����ҵ��������λ����������������һʱ�����ʹ��Ʒ�����������⣬��������¹ʣ�ʹ��ҵ���ܾ���ʧ�� ���ҵ��г��������չ�ᵽ�˲ŵľ�����һ����ҩ������ҵֻ�о߱�����������ε������Ա�����ﵽ�����Ľ�ϣ���ô�����ҵһ���ᳯ���������������г������г�Ϊ��ʤ�ߡ� 3����Ա���ʡ�����ҵ���ʡ�����Ʒ���� ��ҵ��Ա���ʵ��ܺ͡������ֳ���ҵ�����ʡ�����ҵ���Ļ����� ��ҵ�Ĺ�����ѧ����ֵȡ��Ƹ���ƶȡ��������ơ����߷�����ֶΡ���ͨ���綼Ӱ����Ա�����ķ��ӡ���һ�����ڲ�ͬ��ҵ�Ļ������Ӱ���£����ֳ���ͬ�Ļ����Լ������������� ���ԣ���Ա������Ӱ������ҵ�����ʣ���ҵ������ҲӰ�����˵����ʡ� ��Ա���ʡ�����������ҵ���ʡ��������˲��������� ��Ʒ����������ӳ����ҵ���ʡ�����ӳ���˵����ʡ� �ġ���Ա��ѵ ��һ����ҩ������ҵʵʩ��ҩGMP���칤���ĺ��ģ�ʵ���Ƕ���ҵԱ���������ҩGMP���졣ͬʱ����Ա����ѵ�Ϳ��ˣ������Ƕ���ҵԱ�����ʵ�һ����߹��̣�Ҳ�Ƕ���ҵԱ�����ʵ�һ������֤�����̡� 1����Ա��ѵ�Ļ���ԭ���Ҫ�� (1) ��Ա��ѵ��ʵʩ��ҩGMP��������Ҫһ���������쵼���ӣ����˲��롣�ر�����ҩ������ҵ�ĸ���������Ա�����������顢�豸ά���Լ������������ҩ�����йص�������Ա��Ӧ������ѵ������ (2)������ר�ŵĻ���������ѵ��������ѵ�������ƶȻ����淶����������ѵ�Ļ��������¼��йؼ�������������ƶ����ڵ���ѵ�ƻ���������ѵ�ľ��尲�š�������ʶ��������һ����ѵ���������棬�����費�ϵ����ڡ���Ϊ��ҩGMP������һ����չ�Ĺ��̣��������������ķ�չ���²�Ʒ��Ͷ���Լ�����Ҫ��IJ�����ߣ�������µ���ѵ���� ��ѵ�ƻ�Ӧ�����������ݡ���ʽ��ʱ�䡢�ص㡢�μӶ�����ѵ��ʦ��������ʽ�������ŵȡ�ͬʱ����������Ҫ������ʱ������ѵ����ѵ�ƻ���������ҵ�����쵼�����䷢���йز���ʵʩ�� (3)��Ա��ѵҪע�����ʩ�̡�����ʩ�̣�������ϵʵ�ʣ��ռ���������ϡ� (4)��ѵ���迼�ˣ���ѵ�Ϳ��˱����м�¼��Ӧ������ҵ��ѵ��������ѵ�ĵ����������Ʊ��ܡ��Ͻ���ѵ����Ū�����١� (5)����Ƹ��Ա�������������λ��������ѵ���˺ϸ��ɽ����λ�� 2����ѵ���� (1)����ҩ�����йصĸ���ɡ����棬�ص��ǡ���ҩ�������������䡶ʵʩϸ����ҵ�ĸ�������ƶȡ� (2)��ҩGMP�� (3)���������Ļ���֪ʶ�� (4)�����λ�йص�רҵ����֪ʶ����������֪ʶ��λ������ ����ʵ�ʲ�����λ����Ա������ﵽ��������������ʽ�ϸڡ��Դ��¸�������ԡ��߶�ǿ��Ⱦ�ԡ�ǿ�����Լ�������Ҫ�����������������������Ա��Ӧ������Ӧ��רҵ������ѵ����ҩ������Ա���뾭ʡ����ҩ�������ѵ���˺ϸ��ϸڡ���¯�����繤�����ݹ��ȹ��֣����辭�йز�����ѵ���˷����ϸ�֤�������ϸڡ� 3����ѵ��ʽ (1)���ڼ�����ѵ����֯��������̼�����Ա���Σ�������ר�ҵ������Ρ� (2)��Ա�����йش�רԺУ�����е�λ����ҩ�������ѵ�� (3)��ҵ��������֯��ѵ������ʵ�ʲ�����λ����Ա��Ӧ�ڸ�λʵ����ѵ�� ��ҩ������ҵ������Ա��ѵ����ʾ�����2��3�� ��2��3 ��ҩ������ҵ������Ա��ѵ����
����������λΪ��������Ա��ѵҪ�����2��4�� ��2��4 ��������λ��Ա��ѵҪ��
|
������ ��������ʩ
����
��ҩ������ҵ�ij�������ʩ��ָԭ��ҩ���Ƽ���ҩ�ø��Ϻ�ֱ�ӽӴ���ҩ��ҩ�ð�װ���ϵ����������轨�����Լ��빤�����Ĺ��ù��̡�Ϊ��������ҩ������Ҫ��������ҵ����Ҫ���������������������������ҩ����Ӧ�ij�������ʩ�������淶���ij����������ľ�����������ϵͳ��������ͨ�硢ˮ�����塢ϴ����������ʩ����ȫ��ʩ�ȡ�
��ҩGMP�������ԭ����Ҫ��ȡ���д�ʩ��ֹ��ҩ�������ܵ���������Ա�����ϵȵ���Ⱦ��ͬʱҲҪ��ֹ��ҩ������Ⱦ���������ԣ��ڽ�����ҩ��������ʱ�����뿼��ѡ�����˵ij�������Լ������ij������ֺͳ����ڵIJ��֡�������ҩ���͵������涨�����ڽྻ�Ļ����½��У����Խ���ྻ������ʵʩ��ҩGMPʮ����Ҫ�IJ��֡���ͬʱҪ��ֹƬ������Ϊ��������һ���ྻ�������Ǵﵽ��ҩGMP��Ҫ���ˡ��ྻ��������������ȷ��ʹ�á���⡢ά�����ɴﵽ�ྻ��Ч����
���û����Щ����ҩ�������������ĸ���ù�����ʩ���������С���ҩ���������������У�Ҳ���ܱ�֤��ҩ��Ʒ���������ﲻ����ҩGMP��Ҫ��
��һ�� ��������
һ�������
����ҩGMP���涨������ҩ������ҵ�������������������������������ء�ˮ��Ӧ��������Ҫ������Χ������Ӱ����ҩ��Ʒ��������ȾԴ����
������ѡ��ַʱ�������ǽ���ྻ����ʱӦע�⣺
(1)�뽻ͨҪ�������ʵ����룬�����ﳾ�ĸ��š�
(2)�ܿ�ɢ�������۳����������к�����Ĺ�����ҵ������
(3)λ����������Ϸ�࣬��СƵ�ʷ�����·�ࡣ
(4)�ܿ����������������ij�����
(5)ˮԴ��ˮԴ������Ӧ���Ϲ�������ˮ����ͬʱӦ��֤ˮԴ���㡣��Ҫʱ����Ӧ����������ˮ��ʩ��
(6)��Դ����֤������Ӧ����Щ��ҩ����(���翹���ط��͡���ѧ�ϳɡ��䶳�豸)���뿼�DZ��õ�Դ����Ҫʱ������Ӧ���ı��÷����豸��
��7)��ҵ����Ӧ�����������������豸��ԭ�����ϼ���װ�����ܾͽ������
(8)���ϴ�����
���⣬��Ӧ���ǽ�ͨ��ͨѶ����չ��ص����ء�
�������ڻ���
(1)�����ڳ��ء���·������ƽ������ˮ��������¶�����档�������ɵ���ҪʱӦ������ѭ��Ա���Ϸ�����ԭ��
(2)������Ӧ����һ�����̻����������ֲ��ƺ����ֲ�Դ�������������Ũ�Ȳ������к�Ӱ��Ĺ�ľ���������ֻ�����ƺ�����̵��ྻ������ǽ�£�Ӧ����һ�����롣
(3)������Ӧ���ֽྻ�����������洦�ѷ��������Ͼ��豸��Ӧ�������������ﴦ����ʩ�������ڲ�������Ӭ����������
(4)�������������ռ������ı���Ӧǡ���������÷����ֿ⡢�����÷����������Э������������ģ����Ӧ��
(5)������������Ӧ�����������������ֿ����������֣����ǡ�������û���������������ڲ���Ӧ������Ա���Ϸ��Ŷ��룬��������Э������������Э�����ྻ����Э�����ྻ������Ӧ���ڳ��ڻ������࣬����������������Խ���ٴ�Խ��λ�á�����ԭ��ҩ�ϳɵȵ��Ƽ�����ԭ��ҩ�������Լ����ϴ�������¯������������Ⱦ������Ӧ�øõ���ȫ����������·�ࡣ
(6)���������������ķ�����ͼ3��11��
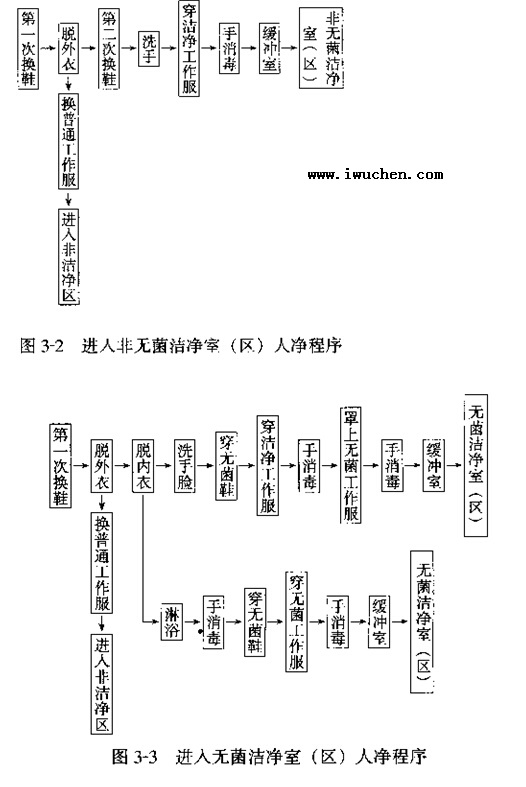
������ �������� �ྻ���������ң�
һ��������
���������� ���� ���
��¯
�ֿ� ԭ����
��װ����
��Ʒ
Σ��Ʒ����Ʒ������Ʒ����ҩƷ
��������
��������ʵ���� ����ʵ�鶯����
ˮ���� ������ˮ
������������ˮ
�����ﴦ�� ����������
���������
����
����
����
ͼ3��1��������
������������Ҫ��
1��һ�����������ǿ�������������Ҫ���ྻ����Ҫ��ԭ��ҩ�ĺϳɳ��䡢�����ط��ͳ������������䡢��Լ��������������ࡢɢ��(�ۼ�)��Ԥ���������ҩ������ɱ��ҩ����װ��ע�������ˮ����ƿ����곴�ϴ��������Ƽ졢��װ���ι����Ⱦ�Ϊһ����������
(1)�㹻�ռ估�������֡�
a) ���հ��ź���������Ҫ˳Ӧ�������̣������������̵��ػء�������
b) Ӧ�������������ݴ�����Ӧ�ֱ�����������ģ����Ӧ������Ϳռ䣬�Ա���������
���Ͱ����豸�����ϡ��м��Ʒ������Ʒ�ͳ�Ʒ������������Ӧ������Զ������������桢���������ҡ��м��Ʒ������Ʒ����Ʒ����������ͬ���ϡ���ͬƷ�֡���ͬ���š��м��Ʒ������Ʒ����Ʒ���������Ա�ǡ�������ţ��Ϸ����������
c) Ӧ������Ĺ��ߡ��豸��ϴ�估���ߡ��豸��������ҡ�
d) ��Ҫʱ���������������м��Ʒ�ʿؼ����ҡ������鹤�����������������Ⱦ��
e) ���������ҡ������۳��϶�����������Լ������нӴ��ж����к�����ʱ�ڸ�����
��Ӧ����ԡ��ʩ��
(2)�������ĵ��桢ǽ�ڼ�������ڱ���Ӧ�⻬ƽ��������ϴ��������ۼ���
(3)����������նȲ�����100lx �� �������նȵĹ��������ֲ�������Ӧ����������ͨ������Ӧ�������������ڼ���Ƿ�������ʹ�á�
(4)����������Ҫ����������������¿�ʪ��ͨ����ʩ��
(5)�����۳���������Ӧ�г�����ʩ��������β���ŷ��еķ۳�����Խ�ꡣ
(6)�������Ŵ�Ӧ���ܱղ��ÿ���ʽ�������з����桢�����ʩ��
(7)��������Ӧ�з��𡢷����������Ȱ�ȫ��ʩ����ȼ���ױ����ж��к����ʵ������ʹ���ij�����ʩӦ���Ϲ��ҵ��йع涨��
2���ֿ� ��ҩ������ҵ�IJֿ⽨������ʩ���ֿ������ʵʩ��ҩGMP������ʮ����
Ҫ��һ�����ݣ���������������ҩ������ҵ�����ԡ�
(1)�ֿ��ڳ����ڵ�λ�á���ͳ����IJֿ����ã�һ�����ڽӽ���������λ�ã�����
����������ȫ���������Ľ������������ǵ������Ǽ������ϴ�������������ĸ��š�����
��һ�������ǣ����Ͻ���ֿ������ϳ��֣��Լ���Ʒ����ֿ������۳��֣����辭��һ��
¶������Ĺ��̣������������������ϵIJ��㣬ͬʱ��������������Ⱦ�Ļ��ᡢĿǰ����
����ҩGMP ��ҵ����Ʋֿ�ʱ���Ѳֿ�����������Ϊһ�壬����������ֺ���������
�Ĺ��̶���һ�����״̬�£�ֱ����Ʒ���۳�����ͨ��ʵ��֤��������ƶ���һЩ��ѧҩ
Ʒ���Ƽ�(��ע�����Ƭ�������������ۼ���Ԥ������ڷ�Һ�����)�������Ǻ����ġ�ʵ�õġ����Ի�ѧ�ϳ�ԭ�ϡ�������ԭ�ϡ��в�ҩ�ķ�����ȡ�����������Կ��Dzֿ����������ֿ�Ϊ�ˡ�
�ֿ�λ�û�Ӧ���ǽ������ϵķ��㣬һ��Ӧ�������Ļ��˴��š��мɽ��ֿ����ڳ��������IJ�λ���������䳵���ڳ����������У����������ɸ��š����⣬�Ӱ�ȫ���ǣ�һЩ�������ϣ��ر���Σ��Ʒ(��ȼ���ױ���ǿ��ʴ)�ֿ⣬Ӧ������Զ�������
����Ϊ���ṹʱ��һ������Dzֿ�ŵײ㣬�����������ϲ㣬��Ҫ���Ǽ���¥����ء������ĺ����Լ����������ٸ��š�
(2)�ֿ�ķ�������á���ҩ������ҵӦ�����ϵ����ʡ������ڲ�ͬ�IJֿ���ڲֿ�IJ�ͬ����һ��Ӧ��ԭ�ϡ����ϡ���װ���ϡ���Ʒ������Ʒ(��ȼ���ױ���ǿ��ʴ����Ʒ������Ʒ������ҩƷ)�ֿ⡣ԭ�ϡ������еĴ���ũ����Ʒ(������о���������۵�)��Һ��(���л���ú���ᡢ��)������(��Һ������������������Һ����)��Ӧ������ֿ⣬�����ȡ�
�ӽ������棬�ֿɷ�Ϊƽ�ضѷż�����ʽ�IJֿ⡣����ҩ������չ�Ŀ��ǣ����ʽ���
�ɵ�����£���һЩ�������ϺͲ�Ʒ�Ծ��������ʽ�ֿ�Ϊ�á�����ʽ�ֿ�ռ�����ϵ���ߣ��������ϰ���Ƶ�ʣ����ڵ��Ի�������
�ڲִ�������ȡ���Һͳ����ң��价���Ŀ����ྻ�ȼ���Ӧ������Ҫ��һ�¡�
(3)�ֿ⽨���Ļ���Ҫ��
A������ֿⲻ��Ҫ���������������Ӧ���������������ֿ������Ӧ��������ģ����
Ӧ���������ʵ�����أ�����������չ�ֿ���������������¶������ѷŵ��������Ʋֿ������ʱ�����������Ĵ���ռ䡢����ռ䡢�����ռ䣬���迼�Dzֿ�����ֵĿռ䣬���������ϼ���Ʒ�ķ��ࡢ�����ţ����ǡ����ͬʱ��Ӧ���Dzֿ��״̬�ռ䣬���������ϼ���ƷӦ�����졢�ϸ��벻�ϸ��״̬����ѷš�
B���ֿ�Ľ�����ʩӦ�ﵽ����Ҫ��
a��ͨ��������ֿ⽨�����ǡ������ˬ������Ȼͨ����еͨ����ʩ�����漰ǽ��Ӧ�и����㣬ƽ�ضѷŲֿ�Ӧ�е�ְ塣��ʪ��������Ҫ������ϻ��ƷӦ�з�����ʩ��
b.�¶ȿ��ƣ� һ�����ϼ���Ʒ���ڳ����±��棬 ���¶�������Ҫ������ϻ��ƷӦ
�п�����ʩ��
c������������Ӧ���ϲִ�Ҫ����ȼ���ױ����ϲֿ�ĵ�����ʩӦ�÷������ġ�
d�������������Ӧ���ϲִ�Ҫ��ͬʱӦ��ѹ�������ѷ죬��������ࡣ����ʽ�ֿ�Ļ���ǿ�ȡ���λ�ߴ��Ӧ����Ҫ��
e���ֿ⽨���ķ�����ͷ��𡢷�����ʩӦ�ﵽ�������ŵı������պϸ����ϺͲ�Ʒ�ѷ�ʱӦ��������ͨ�����ֿ�Ӧ�б�����ʩ��
f���л���ý�������������ȼ���ױ������Һ��ǿ�ᡢǿ�����ϴ���ѡ�ļ��ӹ�
��Ӧ����ʹ�ü���ȫҪ��Ҫʱ��Һ�崢����Χ�з�й©�Ĵ�ʩ��
g����Ʒ������ҩƷ������ҩƷ�������ж����к�����Ӧ����ר�ֻ�ר�档
h���ֿ�Ӧ�з������桢�������ʩ�ʹ�ʩ��
3����������ʵ���� ��ǰ��ҩ������ҵ��ʵʩGMPʱ���ձ���ڡ�����������顱������������ҩ������ҵ��������ʵ���ҵ����á����������黷���������豸���䱸�ȣ����л����ٲ�����Ҫ��֮���������������ŵĸ�����鹤����ʵʩGMP����Ҫ��ɲ��֣�������������ʵ���ҵ����������������Ӻͱ�֤��
(1)��������ʵ���ҵ�����Ҫ��
����������ʵ����Ӧ����ҩ�������ֿ��������������������š��м��Ʒ���������飬������ҩ�������и��ţ������ڸ���������
��������������Ӧ��������ԭ�ϻ���͵�Ʒ���������鹤������Ҫ������Ӧ����������ʵ���ң������������ҡ����������ҡ�����ⶨ��(����������Ч�۲ⶨ���������)����ҩ���鼰�걾�ҡ������۲��ҡ�ʵ�鶯�������ҡ�ʵ����ˮ�Ʊ�����ϴ�����ҡ��Լ������ҡ������ң�ʵ���ˮ��ʵ�鶯�P���������ﴦ���ȡ�
(2)��������ʵ���һ�������ʩ��Ҫ��
����������ʵ���ҵİ칫����ʵ���ҷֿ�����Ӧ��ʵ���Ұ칫��
��ʵ���ҹ�����ԱӦ�и�����ʩ���Ӵ��ж��к����ϼ��鹤����ǿ��������鹤���ģ�������Ӧ����ԡ��ʩ��
�۷��þ�����ƽ����������������ʵ��̨��Ӧ�����з���Ĵ�ʩ��
��ʵ����Ӧ��������ֱ�䡣ʵ����һ�㲻Ӧװ���ȣ����б�Ҫ��װ�յ���
��ʵ���ҵ�ԴӦ�ȶ����Ե�ѹ������������Ӧ������ѹ��Դ�����;��������ĵ�ԴӦ��֤���㡣������Ҫ���֡�ʵ���������䶳�豸Ӧ�б��õ�Դ��
����Ʒ�����ҡ������۲��Ҽ��в�ҩ�걾��Ӧ���ǿ��¿�ʪ��ʩ��
������ʵ����Ӧ�п������������¿�ʪ��ʩ��
��ʵ����Ӧ���о綾Ʒ���汣���䣬���涨������ʵ����Ӧ�軯ѧ�Լ�����⣬�������ã�������ʵ�����д������滯ѧ�Լ���
��ʵ�鶯�﷿Ӧ�����������ϸ�ֿ�������ƽ��켰������ʩӦ���Ϲ����йع涨�����պϸ�ʹ�á��Է�����ʵ�鶯��Ӧ���С�ʵ�鶯����������֤�����ʵ�鶯�Ӧ�����С�ʵ�鶯����������֤���ĵ�λ�ɹ�����������������Ʒ����ҵ�������������ͼ�����ʵ�����﷿���佨�졢��ʩ��ʹ�ñ��������صĹ涨��
��ʵ����Ӧ���ϸ�ĺͳ���ķ��𡢷������������Ȱ�ȫ��ʩ�����ڼ�������������ġ��Ӵ��������ʵ����Ӧ�б�Ҫ��ͨ�硢������ʩ��ʵ���ҵ�ʵ���ˮ�����������P��̭��ʵ�鶯����������������Ĵ�ʩ���Ͻ���������������������ˮ�ܵ����������������
�ڶ��� �ྻ����������ʩ
һ���ྻ�ҵĻ�������
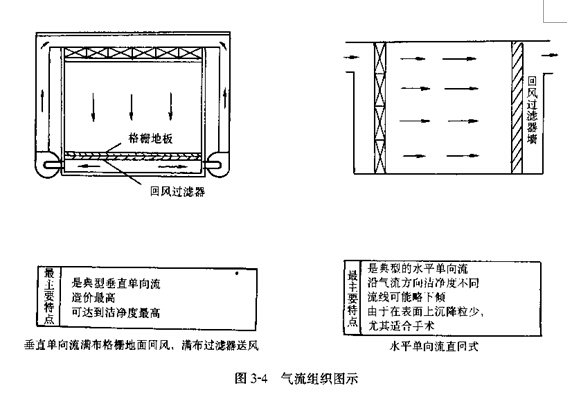
1���ྻ�ҵĶ��� �ྻ����������ྻ�ȴﵽ��������(GMP����30������)���Թ��˻�Ŀռ䣬�����п�����Ⱦ���ų���Ⱦ���ŵ��������ྻ������ͨ�����ʽ���˵İ취�ѿ����е���(������)�����ڸ�����������ʵ�ֵģ�Ϊ�˿�����Ⱦ���ų���Ⱦ�ĸ��ţ��ྻ��������Ҫ���ʵ�������֯��ʽ�������ʩΪ��
(1)���ڿ����Ľྻ��(������Ũ��)����ͨ������ĩ���ͷ�ڵĸ�Ч���Ǹ�Ч�������Ľྻ����ϡ�ͺ��û����ڿ�����ʵ�ֺ�ά�֡�
(2)������(100���;ֲ�100��)�ྻ���ڵĽྻ����Ҫ������һ���ٶȵĽྻ������ʵ�ֺ�ά�֡�
(3)����(10000����300000��)�ྻ�ҵĽྻ����Ҫ������һ�������������ྻ�������൱�ڽྻ������ı���)�Ľྻ������ʵ�ֺ�ά�֡�
(4)���ڽྻ�Ȼ���������������һ������ѹ����ά�֡�
(5)���ڽྻ�Ȼ������������ڷ������ڹ涨�ķ�Χ����ά�֡�
2���ྻ�ȼ���
(1)ԭ��
��GMP����Ŀ����ྻ�ȼ����Ƕ���������������������ʵ�п��ơ�
�ڶԡ�0.5��m�͡�5��m�����������������ơ�
�۳�����Ũ�Ⱥ��ξ�Ũ����ѡһ�ֿ��ơ�
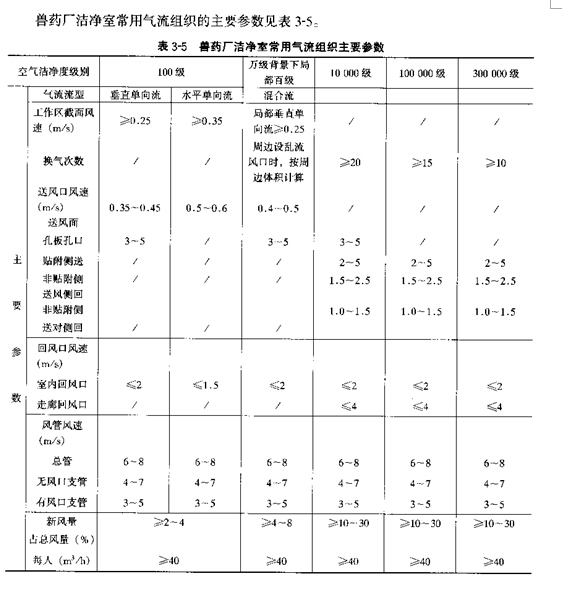
��ҩGMP�涨�Ŀ����ྻ�ȼ��������3��2��
�ܾ�̬��Ϊ���������ձ�״̬����̬��Ϊ�ճ���ر�״̬��
������ҩ���������Ŀ����ྻ�ȼ���ľ���Ҫ��
����ҩ��������ҩ�Ĺ涨����ԭ��ҩ�ľ����桢�������Լ�������Ʒ����������Ӧ�ڽྻ��(��)���У����������Ľྻ��Ҫ�������3��3�������������������й����ݡ�
��3��2 ��ҩGMP�涨�Ŀ����ྻ�ȼ���
�ྻ�ȼ��� �������������/m3����̬�� �����������������̬�� ��������
��0.5��m ��5��m ���ξ�/ m3 ������/��90�� 0.5h
�ټ� 3 500 0 5 0.5 ��ע
�� 350 000 2 000 50 1.5 ��20��/ h
ʮ�� 3 500 000 20 000 150 3 ��15��/ h
��ʮ�� 10 500 000 60 000 200 5 ��10��/ h
��3��3 ��ҩGMP�Կ����ྻ�ȼ���ľ���Ҫ��
���� �� �� �� ҩ �� �� �� �� ҩ ԭ �� ҩ
��������� ������� ��������� ������� ���� ���������� ��������
���ھֲ��ټ� �ٹ�װǰ��������˹���ҩҺ���ƺ�ע����Ĺ�⡢��װ��ѹ�����ڽӴ�ҩƷ���ڰ�װ�������մ�����¶���� ����������10ml������ע������ ���ơ������װ����� �� �� �����ı�¶����
�� ��װǰ������˹���ҩҺ���� ��ע���ϡ�䡢���ˣ���С����ע����ʹ������Ǿ���ע����Ĺ�⣻��ֱ�ӽӴ���ҩ���ڰ��ĵ����մ�����¶����
ʮ�� �����ǣ��ڽӴ���ҩ���ڰ�װ���Ͼ�ϴ���Ҫ�� ��ע���Ũ�䣻�����ܷ�ϵͳ��ϡ�䣻��ֱ�ӽӴ���ҩ���ڰ��ĵ����һ�ξ�ϴ �����ÿڷ�Һ��¶�������ÿڷ�Һ���ڰ������մ����ı�¶���� ���������֯�������á�ǻ�����۲���ҩ��¶������Щ��ҩ�ڰ������մ�����¶����
��ʮ�� �����ÿڷ�Һ��¶�������ÿڷ�Һ���ڰ������մ����ı�¶���� �����ÿڷ�Ƭ�������Ҽ�������������Ƥ��ֱ����ҩ��¶������Щ��ҩ�ڰ������մ����ı�¶���� ���ơ������װ����� �� �� �����ı�¶�������Ҫ��
���� �� �� �� Ʒ ��ҩ
��װǰ������������ ��װǰ���������� ����
���ھֲ��ټ� ����Ʒ�����ơ��ϲ�����⡢���ɡ��������������ȶ����������������ȹ��� ��ϸ�����Ʊ��� �ڰ��Ʒ�Ʊ��еĽ������ջ� ͬ����������ҩ�����Ҫ��
�� ����Ʒ�����ơ��ϲ������ƣ��������ȶ������������������۳������˺ͳ����˹���������������Լ�������Ѫ��Ϳ�ԭ������ķ�װ�� �ٰ��Ʒ�Ʊ��е�ϸ���������ڽ��ֺ��ߵķ�����ϸ��������
ʮ�� �ټ��ߵ�ǰ����������Һ���ȶ������������������Ѫ��ȵ���ȡ��Ѫ���ĺϲ����ܷǵ�����ȡ���ݷ�װǰ���������������Ǽ�����������ϴ���������߷��������ܱ�ϵͳ��������¶������������������ø�������������İ�װ����Һ����װ�����
��ʮ�� ֱ����ҩ�ľ�ҩ�ĺɸ�����ϡ����顢��ϡ���ɸ����Ӧ���Ϸǽྻ����Ҫ���⣬���ɲ��ոü��ྻ�ҹ���
�����ྻ�����ң�������
�����㹤��������ǰ���£�Ϊ��߾���Ч������Լ��Դ���ྻ�ң�����������Ҫ�����£�
1) �����ྻ�ȼ�����ͬ�Ľྻ������Լ��С�
2) ��ͬ�����ྻ�ȼ���Ľྻ�ң������˰������ྻ�ȼ���ĸߵͰ���ߴ��Ͳ��֣���Ӧ����ʾѹ���װ�û����ü�ر���ϵͳ��
3) �����ྻ�ȼ���ߵĽྻ�ң������˾�������������Ա���ٵ�������������ٵ������˾��������յ�������
4) ��ͬ�ྻ�ȼ����ң�����֮�������ϵ���ˡ����Ͻ�����ʱ��Ӧ���˾����ᄏ��ʩ������
5) �ྻ��(��)��ԭ�����ϡ����Ʒ����Ʒ�������Ӧ�����ܿ���������ص����������Լ��ٴ��ݹ����еĻ�������Ⱦ��
6) ��ù�ء�P���������ṹ�ȸ���������ҩ�������������ö����Ľྻ��������ʩ�������Ŀ�������ϵͳ��
������ƷӦ������������ʼ���������IJ�ͬ�����ø��Ե����������ң����������������豸��
��ҩ�ĵ�ǰ��������ȡ��Ũ�����Լ�������������֯��ϴ�ӻ��������������Ƽ��ϸ�ֿ���
7) �ྻ��(��)�����������ı����ҡ������ң���ྻ�ȼ���ͬ����ʹ�ø����ϵĽྻ�ң�������
8) ���ڽྻ������ȡ�������ϣ�Ӧ�ڲִ�������ȡ���ң��价���Ŀ����ྻ�ȼ���ͬ����ʹ�ø����ϵĽྻ��(��)������������ҩ������ҵ�����ڳ�������ȡ�����������ǰ����Ҫ��
9) �ྻ��(��)Ӧ�赥�����豸����������ϴ�ҡ�
10000�����½ྻ��(��)���豸����������ϴ�ҿ����ڸ����ڣ������ྻ�ȼ������������ͬ��100����10000���ྻ��(��)���豸�����������ڱ��ྻ������ϴ����ྻ�ҵĿ����ྻ���𣬲�Ӧ����10000������������ڽྻ��(��)�ڣ�������ྻ�ȼ������������ͬ��ϴ�Ӻ�Ӧ����������ྻ�ҵ�������Ӧ��������������⣬Ӧ�����豸�������ߵĴ���ң�Ҫ��������ϴ����ͬ��������ϴ�����Ź�������ྻ�Ȳ�Ӧ����100000����
10) ����ϴ�ӡ�����������ڽྻ���⡣�������ڽྻ���ڣ�������ྻ�ȼ���Ӧ�뱾������ͬ�����з�ֹ��Ⱦ�Ĵ�ʩ��
11) 10000����������Ľྻ��������ϴ�ӡ���������Ӧ���ڽྻ���ڣ���ྻ�ȼ�����300000�������������������ҡ�����ң���ྻ�ȼ���Ӧ��ʹ�ô����������Ľྻ����ͬ����ͬ�ྻ����Ĺ��������ܻ�ϴ��
12) ��Ա�������Ұ�����Ь�ҡ������ҡ���ϴ�ҡ���բ�ҵȣ�������Ҫ�����á���������ԡ�ҡ���Ϣ�ҵ����ò��öԽྻ�Ҳ�������Ӱ�졣
�ġ��ྻ�ң������Ĺ��ղ���
�ྻ�ҵĹ��ղ���Ӧ���������̼���������Ҫ��Ŀ����ྻ�ȼ����������ֺ��������գ���Ҫ����������������������Ҫ�����ڿ����ྻ���Ŀ��ơ�ͬʱ��Ҫ�������������̣������ֹ����������֮��Ļ��Ӻͽ�����Ⱦ����ҪӦ�������¸���Ҫ��
1) ������ͬ�ྻ����ྻ��������Ա�����ϵij���ڣ���Ӧ�ֱ����á����������Ⱦ�����ϣ�Ӧ����ר����ڡ���Ա�����Ͻ���ྻ�ҵ���ڴ���Ӧ���и��Եľ����Һ���ʩ��
2) �ྻ����Ӧֻ���ñ�Ҫ�Ĺ����豸����ʩ��������������������������DZ���������Ա�����ϵ�ͨ����
3) ������Ա�����ϵĵ����˷ֿ����á����ݲ������ڽྻ��(��)�ڡ�����Ҫ���������ʱ�����ݳ����ǰӦ�軺���һ�����ȷ���ྻ�������ྻ�ȼ�����Ӱ��Ĵ�ʩ��
4) ��ҩ�����ྻ����ÿһ������ÿһ�ྻ����Ӧ�谲ȫ���ڣ�һ��Ӧ����Է����ϸ���һ���������С����Ա����ʱ���ɰ���������Ʒ���淶����һ����
5) �ྻ���ŵĿ�������ͨ��������źͰ�ȫ��Ӧ�������������ž���ѹ����ķ�������
6) �з���Ҫ��Ľྻ��Ӧ���йع涨���á�
7) �˾���ʩ��������������ƽ���ϵ���������������˾������ð������£���Ь������ϴ�����弸�����֡�
�ٸ��¡�
a����ҩGMP���ڸ��µ�Ҫ�����£�
��������ѡ�ġ�ʽ����������ʽӦ�����������Ϳ����ྻ�ȼ���Ҫ������Ӧ����ͬ����ྻ��(��)�Ĺ�����Ӧ�����Ա�ʶ�������û��á�
�ྻ���������ʵ�Ӧ�⻬�����������硢��������ά�Ϳ��������ʡ����������������ȫ��ͷ�������뼰�Ų�����������ȵ��������������
��ͬ�����ྻ�ȼ���ʹ�õĹ�����Ӧ�ֱ���ϴ����������Ҫʱ�����������������ϴ�ӡ����ʱ��Ӧ���븽�ӵĿ������ʡ�������Ӧ�ƶ���ϴ�ƶȣ�ȷ����ϴ���ڡ����в�ԭ�������������������ʹ�õĹ�����Ӧ��������ϴ��
100000��������������Ľྻ������Ӧ�ڽྻ��(��)��ϴ�ӡ������������ҪʱӦ��Ҫ�������
b�����½��˷�Ϊ��ͨ���������ྻ������������������
c��һ��һ��Ϊ��һ�λ�Ь�������»���ͨ�����������ܽ���ྻ��������Ϊ�ڶ��λ�Ь�����ྻ�������������ɰ�30��10����ƣ�ʹ��ɾ���������ѹͨ��һ��ѹ����һ���������ͽྻ�磬��Ȼ������һЩҲ�ǿ��Եġ����ྻ�������ɽ���������������¾ֲ��ټ����ྻ��֮����κμ����������ڲ�ͬ�ྻ��(��)��ͬ����Ĺ�������ɫ�ȷ���Ӧ�����Ա�ʶ������������ͬ�ྻ��(��)��ͬ����ķ�װ�����Ҵܡ�
�ྻ��(��)�����ԣ��ྻ�Һܶ�ʱ����ͬ��������Ҳ���Էֱ���������`�ҡ�
d��������������(���µľֲ��ټ�����)��Ҫ���������������������ݼ��㣬��ʹ���º��º��еĻ�����30����3minʱ���ڣ����䵽���ϵ�ȫ������һ�ζ�����25m3�Ľྻ����ʱ(25�λ���)������ÿ�������ĺ���Ũ����1min�ڽ�����2.02����ʵ���������
e������������ȫ�Ұټ��ྻ���ſڴ������ڣ��������������´���������Ա���ڴ�����һ�����¡���ȻҲ������ԡ��ֱ�ӻ������¾ͽ������������ҡ�
f������ʱ�����·��ͻ��Ϲ�����������ҽ��С���ƻ�Ь�����¡�����(����)������ʱӦ����ͨ��ʽ�����Ǻ���Ҫ��ԭ��
g������ϴ�·�����ˮ�����ij�����Ҫ�����ŷ磬���ָ�ѹ��������������Ľྻ�ȸ������ڻ���(������)����û���(��ϴ�·���һ���ֻ���һ�䣩��Ҫ�������ѹ����ͨ���軺���Ҵﵽ��
����ϴ����ϴ�����������ݣ�
a��һ�������ǰ�IJ�����
b��һ�������ǰ�����ϴ�֡�
c������������ǰ�������������
d����������ǰ����ԡ��
������λ��������һ��ǰ��ã������ʹ�ô������㣬��Ҳ�����ڶ���ǰ�ķǽྻ����Ӧ��ϵ��ػ�������Ա����������Ҫ�������ۺϿ����Ƿ�����ԡ��ʩ��
Ϊ�˼���ˮ��Ӱ�죬����EU GMPָ���ģ���һ��ϴ���豸ֻ�ڵ�һ�����������á����ڶ�������ǰ��ֻ���������ֵ��豸���ɡ�
��������μ�ͼ3��2��ͼ3��3��
�ۻ�����ʩ��������ʩ����բ�ҡ����������Һͻ����ҡ�ƽ����ѹ�����Ҳ�ǻ����ʩ֮һ��
a����բ���������Ų���ͬʱ������С�ң��Է�ֹ��Ⱦ���ֵ����ý�С��
b���������������ø���(20m/s����)�ྻ������ȥ�·��ϳ������豸��ֻ��һ��Ч����һ����˵��
��30��10���ྻ���������ã�
��1�ྻ��һ��ɲ��裬��ҪʱҲ���裻
�ټ��ྻ��һ��ɲ��裬Ϊ��ʾ����Ҳ���衣
���õ��˴�����ʱ���˲�����30����һ̨���ྻ����Ա����5��ʱ��������һ��Ӧ����ͨ�š�
c�������ң������ұ����ͽྻ�磬��ྻ�ȼ���ͬ���뷿��ļ��𣬵��ɲ��߹�1000������һ���ſ�ʱ����һ���Ų�Ӧͬʱ������
�����ҵ������Ӧ��С��3m2��
���һ���Ľྻ��֮����ȫ�ޱ�Ҫ�軺���ҡ�
�������Ľྻ��֮��Ӧ���ݾ�����������Ƿ��軺���ң����Ծ�ʱ�䲻�ܳ���3~5min����Ӧ�軺���ҡ�
���������������ȾԴ����ʹ��ͬ��ҲӦ������軺���ҡ��ڹ����ϳ��ִ������Ӧ�������Ⲽ���ڡ���ƽ���ϻ�һ�������
(8)�ᄏ��ʩ��������ͨ��
��������ƽ���ϵ����Ͼ���(����ᄏ)���ɷ�Ϊ���������(���ξ���)�����ڰ�����(���ξ���)��һ�ξ����������ڻ����ľ����������ڷǽྻ���ڣ�����ֻ���ŷ磬��ͬʱ�ͽྻ�磬�����Խྻ�����ָ��Ȼ���ѹ�����ξ���Ҫ������ͬʱ�߱�һ���Ľྻ�ȣ��������ڽྻ���ڻ���ྻ�����ڣ����Խྻ�����ָ�ѹ����ʱ���������������������
���ڽྻ��֮����������ݷ���������ʱ���ô��ݴ���
���ݴ���Ϊһ���͡������ͺ;����͡�
һ���Ҽ䴫��(������ͬ)������һ���ͣ���Ҫʱ���þ�ʾ��ʶ��ʾ�ŵĿ���������ͷ�������ǿ����ȾԴ�ĺ�����ȾԴ���Ҽ䴫�ݣ����������͡�
�dz����Ľ�����Ⱦ����Ҫ����֮��Ĵ��ݣ����þ����͡����ݴ��ڲ�����������ơ�
���ڽྻ��֮���������ʱ����������ʱ���ô��ʹ������ϵ��ݡ�
a�������豸��Ӧ��10000����ǿ���������ྻ��(��)�Լ�ǿ�����Խྻ��(��)��ͼ���Ľྻ��(��)֮�䴩Խ�������豸�Ķ���Ӧ��֤�����������ѹ��������Ը�ѹ�ࡣ��Ҫʱ�Զ��ڼ����ڵ��������Ļ��
b�����ϵ��ݡ����ǵ��ݾ��������ڽྻ���ڣ�ȷ������ʱ�����ݳ����ǰӦ�軺���ҡ�
�塢����ϵͳ
��һ�� ԭ��
(1)�ϸ����ֶ��������ϡ�
(2)�ϸ�����ֱ����ѭ����
(3)�ϸ�������ѹ�븺ѹ��
(4)��ֹ��Ⱦ���������ࡣ
����ԭ��������������ҩ�������������ù������ҩ���¡��������ṹ��ȸ���������ҩ����������ҩ�����������������������ȼ���ױ����ж��к����ʵ��������漰��Σ�²����ӵĸ�����Ʒ������������������������ʹ��ijЩ�ض�������ĽΣ����Դ�Ⱦ����ԭ����������ԭ��ѿ�߾������������������²���������IJ�����Σ�ն�Ϊ�������ϲ�ԭ��IJ�������ҩ��������������
(��)��ʩ
ͨ����ָ��ϵͳ�������͡��ء��ŷ�ܵ�����������·紦���豸���յ������豸���ͷ�ĩ�ˣ��������ѹ����������ྻ��Ҳ�������ڡ�
1��ϵͳ���ֵ�ע��֮��
(1)����ͬ��Ʒ�ֻ��֣���Ϊ������ҩ������������Ʒ���Ȳ�ͬƷ�ֶԿ����ྻ�ȵ�Ҫ�Խ�����Ⱦ�ķ�����һ����
(2)����ͬ�ļ��ͻ��֣���Ϊ���ͶԾ����յ��IJ�������ʽ��Ҫ��һ����
(3)����ͬ�Ľྻ�ȼ��֣���Ϊ��ͬ����IJ����������Ȳ�ͬ��
(4)��¥���ƽ��������֣���Ϊ�������ڲ��ùܵ��ͻ�����
(5)�����а�λ��֣���Ϊ�������ڽ��ܺ�����
2����Ҫ����ϵͳ�Ķ��� ����ҩƷ���������侻���յ�ϵͳӦ�������ã�
(1) �¡��������ṹ��ҩ�
(2)��ù�ص�ǿ������ҩ�
(3)ǿ�����Pѿ�߸˾���Ʒ��
(4)�����ر���Ҫ�������о��ж���������
��Щ��ҩ��������ˮ�߿��ڸ���Ӧ�е������ټ��ྻ����������
Ҫ�ر�ָ�����ǣ�������ù�����������ҩƷ������Ҫ�ж����Ŀյ�ϵͳ����Ҫ�ж����ij���(���Ƕ���������)����ʩ��
���������ù�س����Ƕ���ϵͳ������Ϊ�������ʷ���Դ�ķ�װ���䣬������Ҫ��������Ӧ���ŷ磬����ط����Ӧ��������Ч���Ǹ�Ч��������
�����װ����Ҳ�Ƕ���ϵͳ����ֻҪ���ŷ�Ϳ����ˣ�����Ϊ��������ѭ���ط磬�ط����Ӧ����Ч���ˡ���Ȼ����������á�
����û�а�װ������װ�ŷ���ѽ��õķ�װ���䣬�����ڻط���ϰ���Ч��Ч��������������ʹ�á�
3��������ѭ����Ķ���
(1)�����ױ���ȼ�����۳��ij��ϡ�
(2)�����ж��к����ʵij���(�������������ԡ����²��Բ�ԭ��IJ�������)��
(3)�п���ͨ��ϵͳ��ҩ�ij���(��ͬʱ������Ʒ��Ƭ���ij���)��
(4)�п���ͨ��ϵͳ������Ⱦ�ij���(�綯������������)��
4����Ҫ��ѹ�Ķ���
(1)��ù�صȸ�������ҩƷ�ľ��ơ�����ر��Ƿ�װ���䡣
(2)�������Դ�Ⱦ����ԭ����������ԭ��ѿ�߾���Ʒ���䡣
(3)�����������ڷ������Ƽ������ϡ�������ѹƬ�Ȳ����ҡ�
��Щ����Ϊ��ֹ��������Ⱦ��Ӧ������ѹ��Ϊ����Ⱦ���ڷ��䣬Ӧ�����ұ�����Ը�ѹ�������ʩ���μ�������֯��Ƭ������������ݡ�
5���ŷ���Ҫ��Ч�����������Ķ��� ������ù���Լ�ǿ������ȵ��ŷ磬Ӧ����
Ч�����������������ŷ��·�ϻ�Ӧ��װ����Ч���Ϲ���������ֹ�����Է�ֹ����ͶԸ�Ч��������Ӱ�졣
6�������յ�ϵͳ��һ��յ�ϵͳ������
(1)�������ˡ�һ��յ�ϵͳֻ��һ�����������ˣ��������յ�ϵͳ��Ϊ�������ˡ��·�����һ�����ˣ���ȥֻ�ô�Ч���������������д�Ч����Ч���Ǹ�Ч�������ˣ��յ�������ѹ�κͻط����ڶ��ι��ˣ���Ϊ��Ч��������Ԥ���ˣ����ͷ������������ˣ���ĩ�����ˣ����ø�Ч��������Ϊĩ����������������10��30����ȫ�������Ǹ�Ч�����������·�Ϊ��������ʱ��1��Ҳ�������Ǹ�Ч��������ĩ����������
(2)ĩ�˹��ˡ�һ��յ��ͷ�ڼ�ĩ��ֻ�з�ڶ����������������յ�ϵͳ�����ͷ�����и�Ч���Ǹ�Ч�����������ȷ�����ڽྻ�ȣ�����ϵͳ�ͷ����Ⱦ������Ҫ��
������Щ�����ǰѸ�Ч���������ڿյ����У��ھ�̬���������ڿ��Դﵽ�൱�Ľྻ�ȣ�����GMP����ÿһ�����ؼ���仯���̵ľ�������������������Ⱦ�ĸ��ʡ�
��Σ���Ч���������ڿյ����ڽ��������ǵ����ӣ������������к�ʵ�ʹ����еļ�顢���յ���ʱ�����ܵ���
�Ѹ�Ч���������ڿյ�������Ȼ�����˹��������������ƽ�ʡ���������ϵͳ�����������˹�����������Ч����
��֮���Ѹ�Ч���������Ǹ�Ч���������ڿյ������Dz�Ӧ���õ�������
(3)�����ܺĴ����յ�ϵͳ��һ��յ�ϵͳ�ķ������ܺĴ�����ʮ����������Ҫ����߾�����ơ���ϸ���㣬ʩ������ȷʩ����װ������������ά����������Ч�ؽ�ʡ��Ͷ�ʺ����зѡ�
7�������յ�ϵͳ��ʽ
(1)��ѭ����ϵͳ��������õ���ʽ��
(2)ȫ�·�ϵͳ���ͷ�ȫ�����������ʿ�����Ȼ��ȫ���ų��������ķ����
(3)���ŷ�ϵͳ��һ���ֿ������ж��к��������������Ъ�ų�����˶�����Ҫ����
һ�����·硣
����������֯
(һ)ԭ��
(1)��������������������һ�»����һ�£��������ų���
(2)��������������ѭ��·�ߣ������������Լ���ͬһ�����������Χ�Ĵ�����
(3)����ʹ�ྻ�Ŀյ���������������ݴﵽ�����㣬�����ػغͶ�·���ﵽ���������õ�Ŀ�ġ�
(4)�����ٶ�Ҫ����ʹ�˲�������кͶ����ﳾ����ɶ�����Ⱦ��
(��)��ʩ
1���ྻ�ҳ���������֯����
(1)�����ϻ�һ���ǽ�ϲ��������������Ч�������ͷ�ڣ���Ϊ��ֱ��������ˮƽ�����������Դﵽ��ߵĽྻ�ȣ�����������ǿ��
(2)�����ϻ�һ���ǽ��ֻ��������������Ч���������Ǹ�Ч�������ͷ�ڣ���Ϊ������ǵ��������ﵽ�Ľྻ�Ⱥ��������������ڵ�������
(3)����һ����Ϊ�����������ܱ�Ϊ���������Ϊ������������ֻ����������ͬ
ʱ���ڵ���ʽ�������ϲ��Ƕ�����������֯��ʽ�����ȫ�ҵ�������ʡ��
���ֲ��ټ����С�������l/10��l/12ʱ���ܱ߿��������ͷ�ڣ���ע�ⲻҪ�ƻ��ټ��ĵ������������ܱ߲������ͷ�ڡ�
���ϼ���������֯��ͼ3��4��

Ҫ˵�����ǣ�
(1)����������ྻ������ͬһ����ҩ�����ڲ�����Ҳ�������к�����ʱ�����Բ������Ȼط硣�з۳����к����ʻ�����������ҽ�����Ⱦ�Ľྻ�ң���Ӧ�������Ȼط磻��������ྻ�ҷ�����ֹ1�������յ�ϵͳ�ģ����������Ȼط硣
(2)�ϱ����ͻط緽ʽ����ǰ���������ѡ�á�
(3)���Ƽ����ͻط緽ʽ��
(4)������ٻ�Ҫ�����涨��130%��
�ߡ���Ʋ���
��һ����ԭ��
(1)������Ҫ��ʱ�����ȱ�֤���յ�Ҫ��
(2)������Ҫ��ʱ�����Dz�����Ա��������Ҫ��
(3)��Ʋ�����ֱ��Ӱ����ҩ������ͨ��Ӱ���˵������Զ�Ӱ�����״����������Ӱ����ҩ���������Բ�����������仯���ǿ��ƵĶ��������GMP����ƽ��Ϊ�������غ�ȫ���̿��Ƶľ���
(��)��ʩ
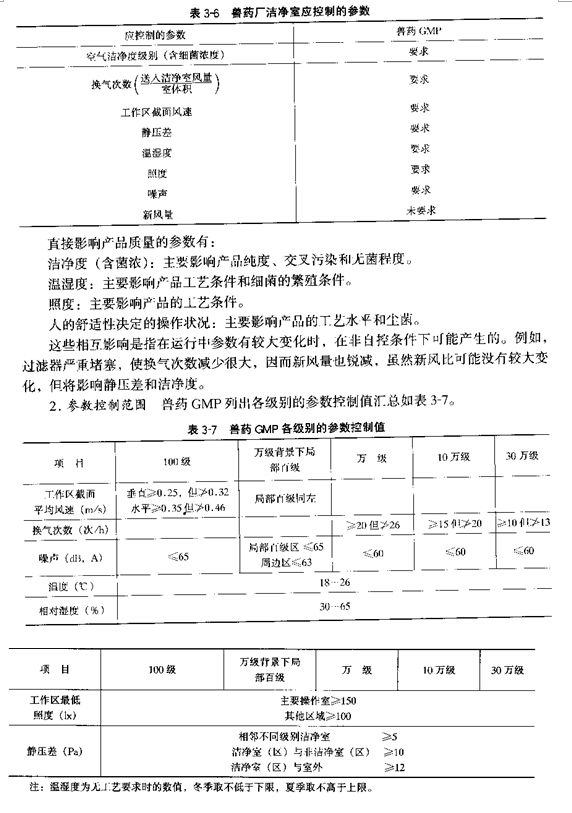
1�� Ӧ���ƵIJ��� ��ҩ���ྻ���ڿ��ƵIJ������3��6��
�ˡ�����װ��
(һ)ԭ��
�ྻ�ҵĽ���װ����ָ������ṹ�������ⴰ֮��ģ�����������¥�桢Ĩ�ҡ���
�������������ϡ�Ϳ�ϡ�ˢ���ȹ��̣��Լ���϶�����ֹ��ߡ������������յ��豸������
�豸���뽨���Ľ�ϲ�λ��϶���ܷ���ҵ��
1����ԭ��
(1)��������������
(2)��������������
(3)�������������
(4)����ҩ��Ӱ�졣
2������ԭ��
(1)����ƽ����
(2)��������ĥ�ԡ�
(3)���治���Żҳ���
(4)���׳�ȥ���ŵĻҳ���
(5)�����õ��Ⱦ�Ե�ԡ�
(6)���ײ������硣
(7)����ʪ����ʪ��
(8)�����Ժá�
(9)���ӹ���
(10)������
(��)��ʩ
1������������������ԭ��
(1)ľ�IJ���¶ʹ�ã�ľ�IJ�����ĥ������������׳�ù����ù������ҩ����У�������ľ��������ù������Ⱦ����������Щ������������ľ�ţ����Dz������ġ�
(2)ʯ��岻������װ�β��ϣ���Ϊ����ྻ�ҳ�Ҫ��ˮ��ҩҺ��ϴ����ʹ�Ƿ�ˮʯ���ҲҪ�ܳ����ζ��ƻ������ԡ�
(3)�����ྻ���������ⴰ��10�ྻ����������ⴰ��Ҳ������˫���ܱմ���(ԭ�����ӣ�http://www.iwuchen.com/a-857/)
(4)����ʱ��ˮ����ҵ������漰Ӫ�����ʣ����������Ƽ���������ǽ�棬��Ӧ��һ��Ϳ�ϣ�Ϊ��ʹǽ�治��ù����Ӧ���÷�ùͿ�ϡ�
2����������������ԭ��
(1)���ڱ��澡����ƽ���⻬�����綥�ѹ��Խ�࣬�Ѷ���ָ�ɷ���Խ�࣬Խ���Ǻõ���ƺ�ʩ����Χ���ṹ�ķ�϶�����ý�ȫ����ƽ��
(2)��Ӧ�����Ե�ͻ���ĵط����細����ǽ����ͬһƽ����ã����������ͬһƽ�棬������б��̨����������ƽ��̨����Ӧ����ǽ����߽Ű壬�߽Ű��ܰ���ǽ����á������䡢���ߺС������Ƶ�Ӧ�������棬�ܱ�Ӧ�ý��⡣
(3)Ϊ�˱����ʱ�����������š����ͷ���ܷ��ŵȣ���Ӧ���ڽྻ�����ڣ�Ӧ���ڼ����в��ڻ�������Ρ��ټ��ྻ���䲻�����õ�©��
3����������ԭ��
(1)���������������辭�����ĵط�����Ӧ��ƴճ�죬�����ϵ�������Ǻ��ӵģ�ˮĥʯ��������������ֽ���
(2)�����ǽ�Ľ��紦�����ң����Ե����ǽ���������R��40~50����Բ�ǡ���������Ľ��ǽ������ǣ�����һ�����ȡ�
(3)����ྻ�����ů��Ӧ��ɢ��������Ϊ�������ֲ�����ɨ��10�Ľྻ���������ɢ��������Ӧ���ù�ܻ�ƽ�壬�Ա�����ɨ��
(4)���ܵ���ˮ�繤�չ��߾�Ӧ��װ��
4������ ������ҩ���ྻ��Χ���ṹ���������ӵġ�
���ڶԵ����һ��Ҫ���ǣ�
(1)��ĥ�ԡ�
(2)���ָ������ᡢ�ҩ��
(3)�����硣
(4)������
(5)���ӷ�ӹ���
(6)����ɨ��
Ϊ�˷�ֹ��������ǽ��Ͷ����Ҫ����ȣ�������������ĥ����ҪҪ���õļ��ֵ������ڱ�3��8.
��3��8 ���õ������
|
���� |
�ص� |
���� |
|
˫����� |
���Ե���ط磬ͨ���Ժã���۸ߣ����Բ��ס�Ը� |
ҩ���Ĵ�ֱ�������ྻ�ң�������� |
|
ˮĥʯ���� |
�⻬��ĥ�������������Ժã��ɳ�ϴ�������磬���� |
ҩ���Ŀ��������ྻ�� |
|
Ϳ�ϵ��� |
����ˮĥʯ�ŵ㣬����ĥ���������ϣ�����״������ã�������� |
ҩ���Ľྻ�� |
|
���İ��ϵ��� |
�⻬��ĥ�����е��ԣ�����������ϴ��ʩ�����ײ������磬��������������ϻ����������������ͬ�����ڴ����ʱ������� |
ҩ�������� |
|
����ɰ���� |
��ʴ�����ʴྭ��������ʩ���ϸ��ӣ���۸� |
ҩ��ԭ�ϳ����и�ʴ������ |
|
�����ֵ��� |
��ʴ�������Ժã�������ϵ���ͻ��ײ�ͬ����С���ʹ�ã����÷���Ʒ�� |
ҩ��ԭ�ϳ����и�ʴ������ |
���ʱ�ISO��ˮĥʯ�ȵ�������ۼ���3��9
��3��9 ISO������ˮĥʯ�ȵ����������
|
���� |
������� |
��ĥ�� |
������� |
���� |
|
�������� ��Ϳ����� ���и�ʯ ˮĥʯ ���� ������Ϳ��IJ��� �ֳ�Ϳ����Ϳ�� �ӵ������ϵ����ϲ�ѹ��ͱ��� ��֬�壬���ȩ����� ����֣���ذ壩 ��ש ������Ϳ������ۺ��� ���ۺ�����̼������PMMA |
�� ���Ϻû�� �� �Ϻ� �� �� ���Ϻû�� ���Ϻû�� ���Ϻû�� �� ���Ϻ� �� �� |
�� �� �� �� �� �� �Ϻ� �� �� �� �� �� �� |
�� �Ϻã��� �� �� �� �� �Ϻ� �Ϻ� �Ϻ� �� �� �Ϻ� �Ϻ� |
�� �ͣ��� �� �� �� �� �ͣ��� �ϵͣ��� �ϵͣ��� �dz��� �� �ͣ��ϵ� �ͣ��ϵ� |
ע�����������Ͼ����������䡢������ԵȻ���Ҫ��
�ھ������һ���У��ã����磬�Ϻã���ɢ����ǵ��硣
�ӱ�3��9�ɼ���ˮĥʯ�൱��Խ��ˮĥʯ������ȡ���ڲ��Ϻ�ʩ�����������ڡ��ྻ��ʩ�������չ淶��������ȷ�Ĺ涨�����õ��ڣ�425��ˮ�ࣨ��Ÿ߸��ã�����С��6�̵���ʯ�ӣ�����Ӱ������������ʩ��ʱ��������ʵ��ʯ��δϴ������ĥ�������ã�ҲҪӰ�����������صĻ���ѣ�ʹʯ�����䡣��ʵ�����ֺ����ʩ��Ϳ�ϵȵ���ʱҲͬ�����ڣ���ˣ������ܳ�Ϊˮĥʯ���治��ʹ�õ����ݡ�
ĥ�ɺ��ˮĥʯ����Ҫ�ò�����ϴ�ɾ������ɺ���ò��ӷ��Ļ�������⣬Ҳ����Ϳ�����Ļ�����֬�ᣬ����־������ذ������Ϳһ�ֽ����ܷ�������������������ˮĥʯ�Ŀ�϶�ڣ���ֹ����һ�����ȵ����á�
����ķ�ֹ���������������Ӧ�������ӵ�������
��ֹ���ѿɲ�ȡ��ʵ���������Ӻ��ƺ��ѡ������ˮ�ࡢ�Դ����������ʵ����ȴ�ʩ��
��ֹ�س��ɲ�ȡ�Ӻ�����������ʯ�㡣���ڵ�����������1�̺�ľ���ϩ��Ĥ�������㣬��ֱ��������ʯ�����ٽ�ע��������Ĥ�Ľ�ͷ��Ӧ�������50�̣����ý���ճ�Ρ�
�������ͼ�Ҫ��ĵ��棬���þ۰�����������֬��������ϩ����ϩ���Ȼ����ȶ���Ϳ�ϡ�
������Ҫ��ĵ��������û�����֬��������ϩ�����ᡢ������Ϳ�ϡ�
��֮���ྻ�ҵij�����Դ�����������ռ80����90�������������ؼ��ˡ�Χ���ṹ�ȷ��棬��Դ���˵���ռ80����90������Ȼ��Χ���ṹ�е���ռ���������������������������ԶԶ���ڿ������ˣ���ˣ��ڵ�����Ͷ��̫���߲�������ض��ø����棨����ƽ�������Ǻܲ���ȡ�ġ��е�Ϊ�˷�ֹ����ƽʩ�����ã��ص�����һ��ˮĥʯ����������ʩ������ƽ���Ǿ���û�б�Ҫ�ˡ�
5��ǽ�� ��1��һ��Ҫ��
�ٲ����࣬����ɨ��
�ڱ����ࡣ
��һ������������ʱ��������
���ͳ����
��ת�Ǵ����û��β��ϻ��ܷ���ϴ�����
��2�����ࡣ
�ٸ�Ĩ�ң�
���ص㣺���ݡ��ྻ��ʩ�������չ淶���涨���ྻ��ǽ��͵�����Ĩ�ұ���Ϊ��Ĩ�ҡ��ص����������ҷ������ñ��ֲ���ƽ���������棬ѹ�⡣
���ϣ�����ɰ����
���齺�
���ص㣺�����Ժã��ް��䣬����������ˮϴ��
�ۻ�����֬�ᡢ�ϳ���֬�
���ص㣺�⻬���ް��䣬��ˮϴ����ʴ��ʩ��Ҫ��ߡ�
�ܷ�ùͿ�ϣ�
���ص㣺�⻬���ް��䣬����ϴ����ʴ����ˮ����ǽ��ùͿ�ϣ���ˮ���ͼ���96h���������䣬��ϴˢ300�����ϣ���ù����14d��������ù�����������6���¡�
���ϣ��л��߷�����֬�����߷��Ӳ��Ϻ�Ч��ù�����϶��ɡ�
�ݴ����ģ�
���ص㣺�⻬����ʴ������ϴ����࣬������ƽ��ʩ��Ҫ��ߡ�
���ϣ���ש���մ��ΰ壨����ư壩�ȡ�
�������:
���ص㣺��ʴ���ͻ����磬�⻬����ϴ���۸ߡ�
���ϣ������������壬���洦���������Ͻ�塢����ְ塢��ɫ�ְ塣��ɫ�ְ�Ļ����Ƕ�п�ְ壬ͿĤ�����Ǵ�����֬��ͿĤ��������Ӳ���Ա�ϩ��֬������֬�������֬��
��װ��ʽ�ྻ�ұڰ壺
���ص㣺װ��ʽ�ྻ���ǵ���������õ�һ�ֽྻ����ʽ���ر������ڸĽ����ϡ���ڰ��ص�����϶��졣������ڰ�����н�������ص��⣬˫�����ڰ廹���и����ص㣬���������пյ��ر��Ǻ���Ҫ��ij��ϡ�˫�����ڰ��ǿ�Ⱥܸߣ����40�̣���900�̣���1.8��2.7m�����۰�����ʯ��̼��Ƶı�ģ���ڰ���ԣ�ÿ����ں���Ϊ4000N�����ڰ�ȫ����Ϊ2500N���ܵ�1000Paѹ��ʱ���Ӷ�Ϊ5��7��.
���ϣ��ڰ�����ĺ�о�������Ҫ������ƶ���ѡ�á�
��֮���ͼ���ྻ����Ϳ�ϡ���ש֮��Ҳ����ȫ���еģ�����Ŀ��ý����ڰ塪������Ļ���װ��ģ�������Ҫ����о���з���������
о�������¼��֣�
Ӳ�ʾ۰�����ĭ���ɱ��ڷ��ݣ�������������������±���л������������ȼ�������ڻ�Ϸ�����ͬ���ֿ�ȼ������Ϩ����
ʯ��̼��Ʒ��ݼ���������̼���Ϊ��Ҫԭ�ϣ�������ά���ͻ�ǿ�������ʹ֮���ݣ�������������ϩ��֬��Ϊ�ϼ����ͣ�������ȼ�͡�
�о۱���ϩ�壺ͨ�������ѹ���ѱ����õľ۱���ϩ���������ְ�֮�䣬ȼ��ʱ������̼������塣
�����ް壺������������ְ�֮�䣬�ʺϷ���Ҫ��ߵij���ʹ�á����ӹ������㡣
��ʯ��壺��ʯ������һ��ְ�ı��棬�ټ�һ��ְ�ʹ���Ϊ���İ壬�������ܺã����Ǽӹ���һ���Ѷȡ�
�š������豸
��һ��ԭ��
(1)�����豸ʱѡ��Ӧʹ�÷���Ϊ������90��������Ч���������˳���80����
(2)��������С����̨�豸ͬʱʹ��ʱ��Ӧע�������ĵ��ӡ�
(3)��Ӱ������Ӱ������������
(4)û��©й��
(5)�������������Ⱦ��
��������ʩ
1�����˱��� Ϊ����ȷѡ��������������������豸�������˽�������ı�����3��10����3��11��
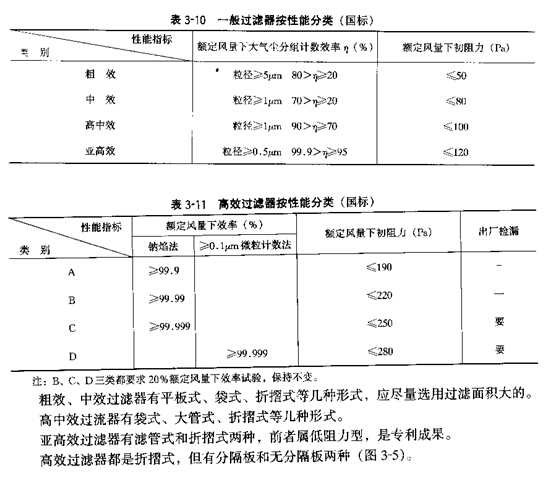
2�����ĩ��ѡ�� Ϊ��ʹ�ྻ���������ڸ��õط���ϡ�����ã�Ӧѡ���б����ɢ��ķ��ĩ�ˡ�
3���ͷ�ĩ��ѡ�� Ϊ�˼���©й������ʹ���з�©��©���õ��ͷ�ĩ�ˡ�
(1)��ѹ�ܷ��ͷ�ĩ�ˡ�������ͷ�ĩ�����ڸ�Ч�������ı߿����ܷ⡢��©����©����ˣ�©й��Ӱ����Ч������Ҫ���档©й��ԭ�����ڷ졢�����ߴ���ѹ����������ѹ��Ϳ˷���©й��
(2)��©���������Ԫ��
���������ͷ�ĩ����ʽ�������ܷ�߿�©й(��ѹ�ܷ��ͷ�ĩ�˳���)����������©й�������Լ���������©����©��������װ�IJ��㡣����ר��������©���������Ԫ����©�ྻ�컨)�ͽ����������⣬���һ��ɰѽྻ�ͷ��������1����
4��������֯Ҫ�� Ϊ��ʹ������֯�ã���Ӧ�����ϻز����֡���������Ϊ�ڴ�����ռ�������һС��ֲ��ྻ����һ�ּ���豸�ǿ��еġ�������������һ��ྻ�������������γɾֲ��İټ��ྻ�����Ǻ��ʵİ취��������������ȱ���ǣ�
(1)������ڲ�����ͷ���ϡ��������ѽ��͡���Ȼ��Ƣ��һ��д�������ֱ�������������65dB����ʵ�������ӽ�70dB�����һ���������ж�̨�����֣��������������3dB����ˣ��������Ϻ��Ѵ�ꡣ
(2)һ������ֶ�������һ���ϻ�����ͼ3��6����ʾ�����ڻط�����ͷ��棬��ȶ����Ͽ��ط�ڵ��ϻط�ʽ������ʹ������·��ǰ��˵���������ϻص�ȱ�����������ͻ����
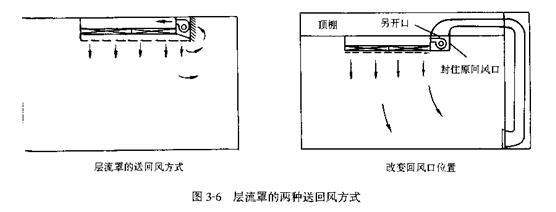
��ˣ���Ϊ��С��������еľֲ��ټ�����Ӧ�Ƽ�ʹ�������ϻز����֡�������ò����ֲ��ɣ�Ӧ�����ܸı����ϻط�ʽ��
(1)�ɽ���ط�ڷ������������ﰲװ�IJ����ֶ��������ط�ڣ�����������ͼ��ʾ���˻ط�����ӹܵ�����IJ�ǽ���ڲ�ǽ�����ط�е������²����ط��(����ֻ�ܵ���أ����䲻��̫��)��
(2)����������Ѿ���װ�ã����Ҳ��������������������ܼӴ��������������´������棬�������������µ����ڿռ���˵���ͱ�������»�����������������û����Ҫ�IJ�����ֻ���˻�ռ���ѡ���Ȼ�������Ȩ��֮�ơ�
5����ȷѡ���ʹ������������������ �����������ԡ����ԡ�������迹���蹲��
�ϵļ������͡�
����ϵͳ�������������ò�����ά����ĭ���ϣ���Ϊ��ά����ͷۻ��Ǻ����Եij�Դ��
�������ϱ������Ҫ�ý��ܵIJ�����������֮�ࡣ
Ϊ�˸�������Ч����ʹ��������ʱӦע�⣺
(1)��װ��������ϵͳ��·������Ӧ���ͣ���Ҫ�ü�ת��������ٶȻ�����
(2)������Ӧ��������ƽ�ȹܶ��ϡ�������������ʱ��Ӧ�����ܿ��������װ������Ϊ�������������������˷ֱ���֧���ϡ�
(3)���������˼��д�����һ�����������ڽ��롣
(4)�������͡��ط���϶���װ��������
6�����������Ч�� ��ﲻ���Ǹ�Чˮƽ���״���������Ⱦ��������Ϊĩ��������ʹ�á�
7����ʪ�� ˮ�����ļ�ʪ����ˮ��������ֵļ�ʪ�������ײ���ˮ���õļ�ʪ�������װ�ˮ����������Ӷ���ˮ�е�ijЩ�ɷִ��˿�������ɶ�����Ⱦ������ҩ����ʪӦ����ѡ������ʽ��ʪ��
8. �·�� �ǿ��ƴ���ྻ�ҳ����ĵ�һ���ؿڣ�Ӧ�����㹻���ӡ�
�·��Ҳ������ɷ�װ�ã���ϵͳ����ʼ�ˣ��������·����ڡ��·�����õص�ĺû���ֱ��Ӱ�쵽ϵͳ���������豸���ɴ�С���������������̣�Ӧ���������ӡ�
�·��Ӧ��������������Ƚϸɾ��ĵص㣬��ѡ���ں���Ũ�Ƚϵ��ֱ仯С��ĵص㡣Ϊ��������еĺ���Ũ���ܵ����Ӱ�죬�·�����ø߶�һ�������5��15m��������ҲҪ����3��4m��һ����˵��Ҫ����ͨ�յ�ϵͳ��ͨ��ϵͳ�Ľ���ڸߡ�����·�������������ϣ�ͬ��Ϊ���������ϻҳ���Ӱ�죬Ӧ�߳��ݶ�1m���ϡ����⣬�·��������ˮƽ���������϶�Ҫ����Զ���ܿ���ȾԴ����Ȼ��Ӧ���ڽྻ������ַѡ��ʱ�ۺϿ��ǣ��·�ڿ�ѡ��ĵص�Ͼ����ޡ����濼�ǣ����ǰ��·�ڲ�������ȾԴ���Ϸ�����總�����ŷ�ڣ���Ӧ���������ŷ�ڵ��Ϸ�ಢ�����ŷ�ڡ�һ���ŷ�ڱ��·������Ҫ�߳�2m��
Ϊ�������ֱ��Ӱ�죬�·�ڴ����象�ְ������İ�Ҷ��(��Ӧ��ľ��)����Ӧ������������ϴ�ĵص㣬��Ӧʹ��������·��֮��ܵ����뾡���̶������䣬�����Ҷ���Ϻܵ��ڻ�����ʹ���·纬��Ũ�Ȳ���̫���ھ����յ�ϵͳ��˵��Ϊ�˱�֤��ϵͳֹͣ����ʱ���������������ϵͳ����Ⱦ��Ҫ�����·�ڰ�װ�·��ܱշ����п��ܵĻ���Ӧʹ�ͷ�����·��ܱշ��������·�ڵĿ�����ͨ��������ɸ����·���������ȷ�������ٿ���2��5m/s ��ѡȡ��
9���ط�� �Ƿ�ֹ��Ⱦϵͳ��һ����Ҫ����
�����ҵĻط�����������ӣ�ǰ���Ѿ��������ط����Ӧ�������(��)���������Ч������(��)�������к��۳�����ʱҲ���Ǹ�Ч���Ч�����������ڻط���ٶ�ӦС��2 m/s�����Ȼط���ٶ�ӦС��4m��s��
�ط��Ӧ�������ھ�ѹ�Ĺ�����һ��İ�Ҷ��ڻ���û��������ܣ�����ҶƬ�������ͨ�������С�������ڵ���ҶƬʱ������������֮�ı䣬���ڵ������ྻ�ң��ط���������ı仯��Ҳ��Ӱ���ٶȳ���Ũ�ȳ���
���������Ƽ�һ�֡�������ɵ�������ڡ�������Ϊ���Ͻ�ͼ3��8�������ṹ��
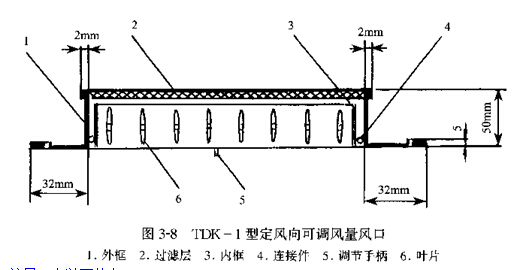
�÷���������ص㣺
�ٿɵ�������ʹ����ڷ����ı������ķ����ر��ʺϽྻ��ʹ�ã������ǵ������ྻ��ʹ�á�
�ڷ�ڽṹ�����ͣ��ɽ��ͳ��ɻط������ĸ���������
�۷�ڴ����˲㣬Ҳ�����˷�����ն�����Ӿ���
�ܷ��ҶƬΪ�������˺���ҶƬ����������
�ݷ�ڵ������ܻ���Ϊ���ԡ�
10���ŷ�� �Ƿ�ֹ��������Ⱦ������һ����Ҫ����
�����յ�ϵͳС���ŷ�ڣ���������������Ҫ�����õľֲ�ͨ����ŷ�ڡ�Ϊ��ϵͳֹͣ����ʱ������ʹ���������ϵͳ����Ⱦ�������Ǿֲ�ͨ����ŷ�ڣ�������ֱ��ͨ���ྻ���ڣ�Ҫ�������ŷ�����ֹ�������������װ�á����õķ��������ŷ������ֹ�������ܱշ�����Ч���Ϲ�����ֱ����Ч���������Լ�ˮԡ�ܷ�صȣ�����һЩ�ϺõĴ�ʩ���ŷ�ڵĿ�����ͨ���������Ҳ�ɰ�������ȷ����һ�㲻��С��1.5m/s����Ҳ����̫���ŷ���ٷ�ӳ�˳��ڶ�ѹ��ʧ��
���⣬�����ų������г�����ˮ�������ڶ���Ϊ�˷�ֹ���ų���ǰ���¶��½����������ڸ�������н�¶��˪�����ŷ��ܵ���¶���ּ��ŷ��Ҫ���DZ��¡�
ʮ��ˮ�����͵�
(һ)ԭ��
(1)������Ϲ��ա�
(2)��ֹ��Ⱦ���ֺ���
(3)����ʹ�á�
(��)��ʩ
1��ˮ
(1)������ˮ��������ˮ��ˮ��������������ʩ����ơ���װ��ά��Ӧ��ȷ���ﵽ��Ƶ�����������Ҫ���ɹ��˷����ڼ����в㡢�е��У����贵ɨ�����ž��ں�ȡ���ڣ�֧�ܵ�����
(2)����ˮ��
���ྻ��(��)�ڰ�װ��ˮ�ء���©���ö���ҩ������Ⱦ��100���ྻ��(��)�ڲ������©������100���ij���ҲӦ���������©����Ҫ�����⻬������ϴ�������ܷ��Ժá�
����ˮϵͳӦ���ݻ���Ҫ��ˮ���ʺ�ˮ���ۺϿ��ǡ�
2����
(1)����ҩֱ�ӽӴ��ĸ����ÿ�����ѹ�������Ͷ�������Ӧ��������������ྻ�̶�Ӧ��ྻ��(��)�ڵĽྻ�ȼ�����ͬ��
(2)Ҫע�⼸������ܵ�����ļ�ࡣ
(3)����ȼ�ױ�����Ĵ��泡��Ӧ�з��������ʩ��
3����
(1)�ྻ�ҵƾ�Ӧ��������ʽ��������Ƕ��ʽ����Ӧ������ʽ������ʽ�ƾߺͶ���ĽӴ���Ҫ�⽺��
(2)�ྻ��(��)�ĵ�Դ����Ӧ���ڷǽྻ��
(3)�ྻ���ڵ�����䡢��ӦǶ��ǽ�ڣ�������ǽ�Ӵ���ԵӦ�⽺��
(4)�ྻ���ڿ����������ʾ�����̣���������������������ڡ�
(5)�ྻ��(��)�ĵ������ߣ��˷����ڼ����в㡢�е��У�����ǽ���ڰ��ܲ�Ӧ�÷�ȼ�ղ��ϣ�һ���ý�����
(6)�ྻ������Ӧ���¹�������������ɢ�ƹ��־��
ʮ���������֤
��һ��ԭ��
(1)һ̬(��̬��̬)��⡣
(2)�������գ��������պ��ۺ�����ȫ��������
(3)������ִ�У�Ӧ�������ʵ�Ȩ���ʼ����ִ���ۺ�����ȫ��������
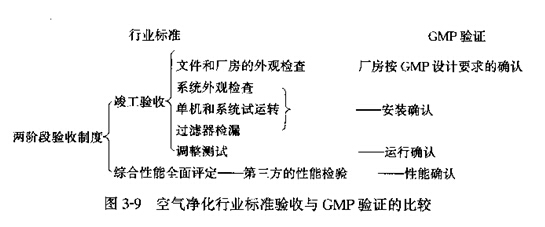
����������ҵ������������GMP������֤�ıȽ���ͼ3��9��
(��)��ʩ
1����װȷ��
��1)��Ҫ�п�������������Ϳ������յ���
��2��Ҫ��һ��ʩ����װ��¼������3��12��210��������
��3��Ҫ����Ҫ���ϡ��豸���DZ��ij����ϸ�֤�������ļ���
��4)Ҫ�п���ǩֽ��
��5��Ҫ������ۼ�飬ע������ȷ�ԡ��ι��ԡ��ܷ��ԡ�����ԺͲ������㡣
��6��Ҫ��������������ת��
2.����ȷ��
(1)�����������ݡ�ϵͳ���������Ժ��������?��Ҫͨ�������������ʵ�֣���ȫ������������һ����ʵ��������ܵļ����첻����
���ԣ�����ȷ�ϱ�����ʩ�����ŵĵ������Լ�¼��
���ݡ��ྻ��ʩ�������չ淶���涨���ü�¼Ӧ���������ݣ�
��ͨ����ķ�����ת���ļ�⡣
�ڸ��ҡ�����֧ϵͳ�����IJⶨ��ƽ�⡣
�����ھ�ѹ�ļ�������
���Զ����Ƶ���ϵͳ������ת��
�ݸ�Ч�������ļ�©��
�����ڽྻ�ȼ���
���⣬��Ӧ�п������յ�������3��22��������
��2���������Լ�¼���������Լ�¼����3��23��������
3.����ȷ��
(1)������
�ٱ����Ѿ�ͨ����װȷ�Ϻ�����ȷ�ϡ�
�ڱ�������㹻����࣬���ܼ���ǰ��������24h���ϡ�
������ȷ�ϵļ�������ɵ������ʼ������ɡ�
�����м����DZ������ڷ������������궨����Ч��֮�ڡ�
(2)�ۺ����ܲⶨ��Ŀ���ز���Ŀ�������¸��
�ٻ�������(�ǵ������������ྻ��)��
�ڹ�����(ȫ�һ�ֲ��ټ���)������߶Ƚ���ƽ������(�������ྻ�һ�ྻ��)��
�۾�ѹ�
�ܽྻ�ȼ���
���¶ȡ�
�����ʪ�ȡ�
���նȡ�
��������
���·�����
��ϸ��Ũ�ȡ�
���ز���Ŀ�⣬�ڱ�Ҫʱ������ѡ��������Ŀ��
���Ծ�ʱ�䡣
���������͡�
������ƽ�жȡ�
������Щ��Ŀ����֤����Ҫ��ҩ���Լ�ȥ�������ǽ���ȷ�ϣ�����GMP���涨����ҩƷ������֤Ӧ������������ʩ���豸��װȷ�ϡ�����ȷ�ϡ�����ȷ�ϺͲ�Ʒ��֤����
�ɼ�������ҩ���Ʒ��һ��(������Ʒ���������������Ʒ���)��ҩ���Լ�ȥ����֤�⣬���������ǶԹ��̿������ջ���ļ��ͽ����ȷ�ϣ��Լ��Ե��������е��ۺ�����ȫ�����������鱨������ʺͽ����ȷ�ϡ�
��û������ԭ��ʱ��Ӧ��������Ŀ��������ⶨ��
����(100���������ྻ�һ��߾ֲ��ټ����ǹ�����������٣�����l00���ķǵ������ྻ���ǻ�������)�������ⶨ��Ŀ��ǰ�ᣬ����������(��������)���Ҫ����������Ŀ�������ʹ�ﵽ����Ҳ������ȫ˵�����⡣���磬������úܶ���ྻ��Ҳ����ˣ����Ȼ�ǰ�ȫϵ��̫����˷ѣ����Ҳ���˵����������������Ʒ�������ʱ���ܲ��ܱ�֤��һ�ྻ�ȡ����������С���ྻ�ȴ���ˣ�����˵��������������������и���ʱ���ྻ�Ȼ��ܲ��ܴ���Լ��ָ���������Ρ���Ȼ�����������С���ྻ��δ��꣬Ҳ�����ܾʹ��ж���ྻ�Ȳ��ϸ���Ϊ�ýྻ�Ҳ�û���ڷ�����ƻ�ķ��������С�
Ҫ��������������ֵ��淶Ҫ��ij����ֵ��20����Χ�ڡ�
4���ճ���� �ͶԽྻ������Ӱ��ij̶ȿ�����ơ�ʩ��������ά����ռ1/3��
����ά������Ҫһ���Ǽ���ճ�����ƶȣ�����������¼����������Ŀ���3��24���С�
������ �豸
��
����
�豸��GMP��Ӳ�����룬��Ҫָ��������ҩ�������������������Ҫ�ĸ���װ�û����ߣ�ͨ�����������ڲ���������ֲ�����װ�û����߳�����(�DZ�)������豸������������װ�û����߽��������豸������������ҵ�豸���������ı��������Ḩ����������������״����
���Ե��������������£����������������豸���ܵĸߵ����ܷ�֤��Ʒ��������Ҫ����֮һ���ܷ���ȷѡ������ҵʵ������Ӧ�������豸������ʱ������ά�ޡ�У�����ȷʹ����GMP�豸��������Ҫ���ڡ���ѧ�����ڲ��Ͻ�������ƺ��������ܸ��ߵ��豸�ڲ���ӿ�֣���ҩ������ҵӦ���ݲ�Ʒ����Ҫ��ʱ�������豸���������豸���Ա���õ�����GMPҪ��
��һ�� ѡ���豸��ԭ��
��ҩGMP(�淶)�涨������ҩ������ҵ����߱�����������Ʒ����Ӧ�������ͼ����豸�������ܺ���Ҫ��������Ӧ�ܱ�֤�����Ͳ�Ʒ�������Ƶ���Ҫ����Ϊ�ˣ���ѡ���豸Ӧע������ԭ��
һ������������ʹ��
��ҵ��ѡ���豸ʱ���ڲɹ�������豸ǰҪ�ӱ��ĽǶȼ���������豸�Բ�ͬ���Ͳ�Ʒ�����ã�ά����ӦЭ����������������ȷ����������С�������������豸��
�������豸��Ŀ����Ϊ��ʹ�ã��豸ֻ����ʹ���в��ܷ������á���ȷ�ء�������ʹ���豸�����Լ���ĥ�𣬷�ֹ���ϻ����������õļ������ܺ�Ӧ�еľ��ȣ��ӳ��豸���������Ӷ���ַ����豸Ӧ�е�Ч�档Ҫ����ʹ���豸������Ҫ���ݸ����豸�����ܡ��ṹ�����ȡ�ʹ�÷�Χ�ȼ�������ǡ������ʹ�ã����ܱ�֤�豸���������У����ⷢ����������֤������ȫ����ַ����豸�Ĺ���Ч�ʡ�
Ϊ�˱�֤�豸�İ�ȫ����ַ����豸�����ܣ�ʹ�豸�����״̬��ʹ������Ϥ�������豸�����ܡ�����ά���ͱ���������
�����ܹ���֤��Ʒ����
Ϊ��֤��Ʒ����ÿ̨���豸��ʽ����������ǰ������Ҫ���豸�����Է��������������������㹻�������IJ�Ʒ��ÿ��ȡ������Ʒ������й���������ѧ��ҩѧָ�ꡣ���뱣֤��ȡ��Ʒ���㹻������ʹ���豸�������ҶԷ����������Ҫ�������ޡ����������Ĵ�С����Ӧ��ҩƷ�ĺ����������������豸���Զ�����
������ֹ��Ⱦ�ͻ�ҩ
���չ淶����һҪ�������������͵���ҩ��е����Ƴ�������ʽ��ܵ������ߣ��Ծ������ٲ�Ʒ��ת���ڣ��Ӷ����˺Ͳ�Ʒ�ĽӴ�������ͣ����⣬�ڲ�Ʒ�Զ���ת�����У������ܱ�װ�ã��ڿ��ڹ�����l00���ֲ�������������ѹ��������ֹ�������Բ�Ʒ����Ⱦ��
�Բ��������ֱ�¶�ļӹ��豸��һ��Ӧ�����ܵظ��Է�ջ��ڸǡ����罫ѹƬ�����²���װ�������֣�����ͳ�ıֿ�ʽ���»���Ϊ���ʽȫ�Զ����»���תƿ����Ƥ��������Ϊ���˴����ȡ�
��Ⱦ�ı�����ʱ�������ڶ��������豸������ϡ�����С���豸�������ڲ�ж�IJ��֣��������������������Թ̶��Ĵ�������ܵ�ϵͳ�Ⱦ�Ӧ�������˵ľ͵������������ܵ���ѹ���������
��Բ�Ʒ��װ�п��ܳ��ֵ�������ǩ���¹ʣ�����Ƶİ�װ��Ӧ���ǰ�װ������ʶ�������Ծܾ��д���ı�ǩ��
�ġ�����ά�ͱ���
һ���豸�����ɳ�����Ƶı����ƻ������ּƻ�Ҫ���ڶ��豸���м�顢У����������ά�ޣ�ֻҪ�ɹ�����ɲ���¼���ܷ�ֹ��������¹ʵķ�����GMP������Ҫ���豸Ҫ�������ּ�顢У����ά�ޣ�����Ҫ������ҩƷ����֮�佫�豸���ֻ�ȫ����ж�Խ���ȫ����ࡣ���ѡ�����豸������ά����࣬�ͺ��ѱ�֤�豸��������ת�Ͳ�Ʒ������
�ڶ��� ���豸��Ҫ��
һ�����豸�ĺ��Ҫ��
���豸�ĺ��Ҫ�ɸ���Ϊ����������棺
1��ѡ��Ҫ�� Ӧ�����ۡ�����£��
2������Ҫ�����ȡ��ͺ�����ʴ����ĥ������
3������Ҫ�� ����ж���㡣
4������Ҫ�� ���ã����ȸߣ��������ϡ�
5��ʹ��Ҫ����ڲ�����ά����
�������豸��һ��Ҫ��
1�������� Ӧ����ҩ���������ࡢ���͡����պͲ�Ʒ����Ҫ������Ӧ������С������ɱ����ţ����
2���ȶ��� ��ҩƷ�Ӵ��ı��治����ҩƷ����������Ӧ�������ͳ����ʻ�������Ʒ��
3���ܱ��� ��������ȾԴ��Ⱦ��Ʒ��������Ҫ����ȴ�IJ���������ҩƷԭ�ϡ��������ӡ��м����ҩƷ�����Ӵ���
4����ȷ�� Ӧ��������������龫ȷ�ȵ�Ҫ��
�������豸�ľ���Ҫ��
(1)�����Ƽ����������Ϲޡ���ϲۡ�����豸��������е������ԭ��ҩ���ơ������װ���豸������������������������Ӧ��
(2)Ӧ�������Ʒ��֤���й�Ҫ���������йز����IJ��Ե㼰����ȡ���ڡ�
(3)�ྻ��Ӧ���þ��з�������������Ⱦ���豸��
(4)Ӧ�ṹ����Ҫ��ϴ��������㲿��Ҫ���ڲ�װ��
(5)����ҩ��ֱ�ӽӴ����豸�ڱ���Ӧ���ò���ҩ�ﷴӦ�����ͳ�����������ҩ��IJ��ϡ�
(6)�����װ���豸Ҫ������ϴ�ڡ��豸����Ӧ��ࡢ����ࡣ�豸�ڱ�Ӧ�⻬��ƽ�����������ǡ�ɰ�ۣ�����ϴ����ʴ��
(7)�����ڵ��豸������������Ҫ���⣬��Ӧ�������Ҫ��
(8)����ˮ��ע����ˮ�������������ùܵ��IJ���Ӧ������ʴ����ܵ���Ӧ�в�ѭ���ľ�ֹ���䣬���涨��ϴ���������������ͨ����Ӧ��װ������ά����ˮ�Գ�����������
(9)����ˮ��ע����ˮ���Ʊ�������ͷ���ϵͳӦ�ܷ�ֹ���������ͷ���Ⱦ��ע����ˮ�Ĵ���ɲ���80�����ϱ��¡�65���ϱ���ѭ����4�����´�š�
(10)�������в����ϴ���豸������顢��ɸ����ϡ����������ѹƬ����װ���豸�˾ֲ��������Χ���Ͳ�������װ����
(11)�豸���ܵ��ı��²�������ƽ�����⻬�������п������������䡣������ʯ�ޡ�ˮ��Ĩ�棬��ò��ý�����DZ�����
(12)����豸�ڲ�������������DZ���⣬������֤��
(13)��ҩ��Ӵ���ѹ��������ϴƿ����װ�������õ�ѹ������Ӧ�����͡���ˮ��������������ྻ����ʹ�õĹ������ڵĽྻ�Ҽ�����ͬ��
(14)��̬�����������P�����������õĿ���Ӧ������β��Ӧ�������ſա�
(15)���졢�ӹ�����װע���ʱ������ʹ�ÿ����ͳ���ά��Һ�����װ�ã����������ӷ���ά�ͳ��Թ���װ�á�
(16)ʹ�����͡���ȴ�����ܷ��IJ�����Ҫ�з�ֹ��й©����Ⱦԭ�ϡ����Ʒ����Ʒ��װ�����Ĵ�ʩ��
(17)��ҩ��ֱ�ӽӴ��ĸ���������ѹ�����弰���������Ӧ���þ���װ�á�����������������������������Ӧ���ϸ�����涨�Ŀ����ྻ��Ҫ�����豸�����Ӧ�з�ֹ���������װ�á�
(18)�������ӹ�����װ��ù�ص�ǿ������ҩ�ijЩ����ҩ����ԡ��ж���ҩ��������豸����ֿ�ר�á�ijЩ������������Ʒ�֣��������豸����ר�á�
(19)�Բ������������豸��Ӧ�ֱ��������������װ�ã����Ʋ���������
��ҩ����Ʒ��֮�࣬ʹ���豸��Ҫ����죬������һһ�о٣������������ر��豸�������������һ��������ݡ�
������ �豸��װ
һ���豸��װ������Ҫ��
(1)�豸��װ�IJ���Ӧ���Ϲ������̣��Է�ֹ��ҩ����©������ϵ�в����豸���Ͱ��������а�װ��ע��Һ������豸��Ҫ�����ڴ������Ʒ�ıؾ�֮·�ϣ��Է�ֹ���ܵ���©�������
(2)�豸��װӦ���б��ڲ����ͷ���ԭ���ϵĿռ䡣
(3)�豸�İ�װӦ�����豸ά�ޡ���������ϴ����������������ܵĸ������Ǩ��Ϊ�ˣ��豸��ǽ�������豸���ܵ�������֮��Ӧ���ʵ��ľ��롣
(4)�豸�Ŀ��Ʋ���Ӧ����װ�ڲ�����Ա���ڹ����ĵط�����Ӧ��ֹ�˶��豸����Ⱦ���豸���˵�Ӱ�졣
�����豸��װ�ľ���Ҫ��ͷ���
(1)���������豸���������������·�ߣ����Գߴ�Ҫ�����ɽ����豸ͨ������Ҫʱ�Ѽ��ǽ��Ƴɿɲ�ж������ǽ��Ҳ�ɰ���Ʒ���Ԥ�Ƚ������豸��װ��ָ��λ���ϣ�Ȼ����м��ǽʩ����
(2)���豸��װ�ڿ�Խ��ͬ�ྻ�ȼ��ķ����ǽ��ʱ�������ǹ̶��⣬��Ӧ��ȡ�ܷ�ĸ���װ�ã��Ա�֤�ﵽ��ͬ�ȼ��ĽྻҪ��
(3)�����豸��Ӧ����ǿ���������ྻ��(��)�Լ�ǿ�����Խྻ��(��)��ͼ���Ľྻ��(��)֮�䴩Խ�������豸�Ķ���Ӧ��֤�����������ѹ��������Ը�ѹ����
(4)����ƻ�ѡ����㡢���ɵĴ����ߣ��紫�ʹ���С�������ۡ����ӹܡ�����϶��ȣ��Ը����豸֮������ӡ�
(5)�ྻ�Ҿ��������������豸�����ر�Ҫ���⣬һ�㲻����ؽ���˨�����������豸����ʱ���ɲ��ÿ��ƶ�����ʽˮĥʯ��������飬����ط��ã���Ӱ��¥���ࡣ
(6)���豸���ӵ���Ҫ�̶��ܵ�Ӧ���������������Ƽ�����
���Ľ� �豸����
�豸��������ת���ؼ����ڹ���������˵�豸��������ʹ�ã��߷ֹ��������Ⲣ��Ϊ�������ʧ֮�������������壬״̬������ֻ�ò��ܣ��������ò��ã��ò��ã������ܿ���һ�ѷ�����
�豸��������Ѱ취�ǽ�����ȫ�����ƶȣ�����ʵʩ���������¼���浵������֮���������;��
һ���Ǽ��ƶ�
(1)�����豸���������DZ��������ȱ�����ű���Ǽ���ᡣ
(2)�̶��ʲ��豸���뽨��̨�ˡ���Ƭ��
(3)��Ҫ�豸Ҫ��̨������������ר�˹��������������ݰ�����
���������ҡ��ͺš����кš�
����Ӧ�̡����ڡ��۸�
���������������
����������(ʹ��˵���顢���ͼֽ��װ��ͼ������Ʒ�����嵥�ȣ���
��������ͬ����Э���顣
����װλ�ã�ʩ��ͼ��
����֤��¼�������¼��
��ʹ��ά��¼��
���¹ʼ�¼��
��������ϵͳ�����ƶ�
�����й��ߡ����ι��̣����ƶ���ϵͳͼ������ר�˸��������
�������������ƶ�
�����������ͼ�����������DZ��������������ȵ����÷�Χ�;��ܶȽ��а��ڼ��飬�������������������Ҫ���ƶ�У���ƻ������ھ�������������У�飬�����Ե�״̬��־��У����Ҫ��ʹ��Ƶ�Ⱥ;���Ҫ��Ϊ���ݡ�У���ϸ��(��)У���ϸ�֤����дУ����¼��
�ġ���Ʒ���������ƶ�
����ҵ��ʹ�õĻ�е�豸����ʩ���ñ�Ʒ����Ҫȷ����������������Ҫ����ר�˹������������Ӧ���¼��
�塢ά�ޱ����ƶ�
�豸ά�ޱ�������ҪĿ����ʹ�豸�������롢��༰���õİ�ȫ״��������ҩ�����������Լ������ԣ�һ���豸���ֹ��ϻ��¹ʣ���Ӱ���Ʒ��������вԱ���Ľ�����������������ҵ�����ϴ�ľ�����ʧ��������Щ��λ��ʵ��һ�ֽ���Ԥ����ά���ļƻ���
Ԥ����ά�������豸�ڹ涨������һ������ʱ���ڽ����й��ɵļ���ά�����Է����������ž��¹ʷ�����ȷ�����������С������ƶȱ��滵����Ҫ��ѧ�öࡣ
Ϊ��֤�豸��ʹ�����ܺ��ӳ��������������ҩ������ҵӦ��
1���ƶ��豸���������
(1)ά�ޱ���ְ��
(2)�����ƻ���
(3)������ݡ�
(4)����������
(5)������¼�ȡ�
2���豸��� ����豸������������ܡ�ð���Ρ�©�����������档
(1)���ճ�ά���м�ǿѲ�ؼ��ޣ�������ԱӦ�������ֳ�Ѳ�ؼ������������������������
(2)��ijЩ��Ҫ�豸��Ҫ���ڼ���ά�ޡ�������ҵÿ��Ӧ���ڳ�һ��ʱ��������豸����ȫ���顢�������Ա�֤������ת��
(3)���벻ͬ����ྻ����ά�ޱ����豸���й���Ա��Ӧ����Ӧ�ķ�װ����ʹ���Ѿ���������Ĺ��ߺ��豸����ά��ʱ�������ܱ�����ʱ��������ǰӦ����ϴ��������
(4)Ϊ�˱�֤�����ά�ޱ����������Լ�����ԱӦ���ڽ��м���ҵ����ѵ��
3���ƶ��豸���ϴ�ӹ��
(1)ϴ�ӷ�����ϴ�����ڡ�
(2)�ؼ��豸Ҫ��ȷ��������÷�����
(3)��ϴ���̼���ϴ������й�����Ӧ��¼���档
(4)���豸����ϴ��������ֱ�ӽӴ�ҩƷ�IJ�λ�Ͳ������뱣֤����������������ڣ���ҪʱҪ��������ѧ����֤����������豸Ӧ��3����ʹ�ã�����Ӧ���������
��5��ͬһ�豸�����ӹ�ͬһ����Ʒʱ��ÿ�����Ҫ��ϴ�����ͬһ�豸�����ӹ�ͬһ������Ʒʱ����Ӧ����������Ʒ���ص�涨������ϴ�����ڡ�
(6)���ƶ����豸��������ϴ����ϴ��
(7)����������ʹ�õ��豸���������ص����������ǵ���ϴ��������ϴ��Ӧ����Ӧ������Ҫ������Ӧ��
(8)���������һ����ø�ѹˮ��������(�Բ��������)������ʹ�ú��������С�
������������Ͽɵ����ϱ�ǩ��ǩ����ע�����ڣ�Ȼ������һ�ָ���ָ�������ڸDZ��档
����ʹ�ù����ƶ�
(1)�豸��������ʹ�ã�Ӧ��ʹ��˵���飬����ҵָ��ר���ƶ����������(S0P)����ȫע�����
(2)������Ա�뾭רҵ��ѵ�����ˣ�ȷ��������Ӧ֪Ӧ��ʱ���ſ��ϻ�������
��3)�ϸ�ʵ���豸ʹ��Ҫ���ˣ�������ר�˹�����ʹ�õǼǵĹ涨���������豸���м�¼�ͽ��Ӽ�¼��
(4)�豸Ӧ����ȷ��״̬��־�����������������������ڼ�����������������ȡ���ѹ����豸�����ڷ�װ��������Ƽ��Ĺ���豸�������������ȱ�����֤��������֤���ںͱ�ʶ�������������������DZ��������������ȱ��뾭�������飬δ����֤��У����豸����ʹ�á�
(5)���ϸ�Ļ���ʹ�õ��豸�����п���Ӧ�����������δ�ܰ��ǰӦ�����Ա�־��
(6)��ҵ�豸��������������Ӧ���ڶ���ҵ�ڸ����豸��ʹ����������ۺϷ������棬������ҵ�ֹܸ����ˡ�
�ߡ���֤�����ƶ�
�����������֤������ݣ�
�� ���¼�¼����Ŀ¼
����4��1�豸��ϸ�� ����4��2��������̨��
����4��3�豸���ޱ�����¼ ����4��4 �豸�¹ʼ�¼
����4��5��Ҫ�豸���м�¼ ����4��6�豸�����ƻ�
����4��7�豸��¼ ����4��8��������ö��ƻ�
����4��9��������У���¼ ����4��10�豸���¼�¼
����4��11 �豸�ۺ�״����
������ ����
����
һ�����ϵĸ���
������ԭ�ϡ����ϼ���װ���ϵ��ܳơ�ԭ����ָ����ҩƷ�����ġ��涨�����ġ����е���Ч�ɷ֡������ǹ���ҩ���Ƽ��ز����ٵ���ɲ��֣�������Ч�������Ƽ��ij��͡��ȶ��Լ���Ʒ��������ҩ���л����ѧ���涼�����е���ϵ����ˣ���ҩƷ�����������У�Ӧ��������ԭ��ͬ��Ҫ������ͬ���Ĺ�������װ�������������װ���ϼ���ǩ��ʹ��˵���顣
�������Ϲ��������ݼ�����
�����Dz�Ʒ�Ļ��������������������������ʲ�Ʒ��ǰ��ͱ�Ҫ������
��ԭ�Ͻ�������Ʒ������ҩƷ����ʵ������������ת�Ĺ��̣����漰����ҵ�����������������������в��ţ��������Ϲ�������������Ҫ�������Ҫ�������¸�����Ĺ�����
(1)������ȫ���Ϲ����ƶȣ�ʹ���ϵĽ������գ����桢���š�ʹ�õ��������¿�ѭ���з�������ʹ��������������������ǿ��
(2)���ӹ���������ƹ������ϸ�ִ�й�Ӧ��������ƹ��������߹���������ϸѡ�����ȶ����������õĹ�Ӧ���̡�
(3)�ϸ������������ϰ����������ء�
(4)��ǿ�淶�ִ�������ȷ��������������ת�����������ȶ��ɿ���
��һ�� ���Ϲ���ϵͳ
��ԭ���ϵIJɹ���⣬��װ���ϵ����ӡˢ������Ʒ������ȫ���̣����������ϵ���ת����һ��ͳһ�Ĺ���ϵͳ����������Ϲ���ϵͳ��
һ������Ԥ��
��������������ԭ��ָ���������۲��Ÿ��ݶ��������г�Ԥ�����ݣ������ƶ�����Ԥ�����Ԥ��������ݸ�����Ԥ�����ڡ���Ʒ���ơ��ɶ����š���װ��������ȡ�
���������ƻ�
�����ƻ����Ÿ�������Ԥ�������Ʒ�Ŀ������ƶ������ƻ���Ȼ����������ԭ���ϼ���װ���ϵ��������ƶ�ԭ�������������ԭ�����������Ӧ������ԭ���ϵ����ơ����š�����Ҫ�������������������ȫ�����������ʱ��ȡ���Ҫ��������������������
�����ɹ��ƻ�
�ɹ����Ű�ԭ������������ƶ��ɹ��ƻ��������ݰ���ԭ�����ϴ��š����ơ�����Ҫ���������������������λ���������ڵȡ���Ӧ���������뱨��ʱ�䡣
�빩����λǩ��������ͬ���뵥�����ݰ������ϴ��š����ơ�����Ҫ�����������װ��������š�����ʱ�䡢ΥԼ���εȡ�
�ġ��ֿ��ա�����������
���ϵ����ֿ����ԱӦ���Ƚ��յ���ԭ���ϼ���װ�����˵����ڴ�������Ȼ������ϵ�Ʒ�������š����š�����������������ļ��鱨�浥����һ��ˣ�������ϸ��¼��
�б�Ҫʱ��Ҫ�����ϵ����װ�����ʵ�����ࡣ��ͬ��������Ҫ��Ҫ��ֿ�������š�Ҫ�����Ե�״̬��־���ˡ����Ҫ�����
�塢���������������
(1)Э���ʼ첿���ƶ�������������
(2)������λ������ơ�
(3)�����������¼������װ��¼��ƫ���¼����������ǩ���¼�������������
�����ʼ첿�ż���
(1)���ϵ�ȡ�����������������顣
(2)���Ŵ���֤���ϸ�֤�벻�ϸ�
(3)���ż��鱨�浥��
�ߡ�������������
�������������ϵ�ʹ�ú����IJ��ţ���������ʱ����Ҫ���ݺ��ϵ���Ʒ�������š����š�������������λ�Ƚ�����˲���ʱ��¼�����ˡ���������ƽ��������ƫ���ʱ����ԭ��д��ƫ��档
�ڶ��� ���ϵIJɹ�
Ϊ�˱�֤���ϲɹ�������˳�����У�ȷ�����ϵ�����ˮƽ����������Ϲ�����λ����������ơ�
�����Ӧ����������������֯ʵʩ���������������������ϲɹ����Ź�ͬ��ɡ�
��Ӧ��������ƹ����������¡�
һ������ѡ��
��ҩ�������õ����ϣ�Ӧ������ҩ����ҩƷ������װ���ϱ�������������Ʒ��ԭ�����ϡ����ƷӦ���ϡ�����������Ʒ��̡�������������Ʒ���DZ����������йر���Ҫ���ö���ҩ��������������Ӱ�졣���ϲɹ���������ҵ�ƶ���ԭ���ϼ���װ���ϱ�����ΪѰ����λ�����ݣ�ͬʱע���ռ�������λ�������������鷽�����Ա������������Ž��бȽϺͺ˶ԡ�
���ϲɹ����Ž���ҵ�ƶ����������빩����λ�ܴﵽ�����������ж��գ����ܴﵽ������ﵽ��ҵ�ƶ�������������Ӧ��һ���˽����λ�������������Ա��֤�ա���Ʒ�����豸����Ʒ��������ͼ����������״�������������������������������ȣ���������Щ��������Թ�����λ���г���ѡ��
������������
���ѡ�ϸ�Ĺ�����ȡС�����������������ż��顣ͬʱ��������ҵ�������������Է����öԷ������ѽ��м��飬���Ƿ��ܹ��ﵽ�����껴Ҫ��
�����������
С������ϸ��ѡ�������ռ��������ֱ���������λ�ܿ��ܳ�Ϊ����ҵֵ�������Ĺ�Ӧ��ʱ��������������Ӧ��ͬ���ϲɹ����Ű�������Ƶ�Ҫ��Թ�����λ������ʽ���飬��������ơ�
������λӦ�߱��������ǣ�
(1)֤����ȫ�����������ܲ����������������ò�Ʒ�ķ����ļ���
(2)������ʩ���豸�ܷ���������������Ҫ��
(3)������������������֤��ϵ���ơ�
(4)��Ʒ��װ����Ҫ��������ȫ���������á�
(5)�����ļ�����¼�淶����ѧ��������
(6)��Ա���ʸߣ����������ۺ�
�ġ�������֤
��������ƽ������ĵ�λ�ɹ��������ϣ����磺�ɹ�1��3����Ʒ��Ӧ����ԭ���ϻ��װ���ϣ�����1��3����Ʒ�����й�����֤��ע��۲����������п��ܳ��ֵ�ƫ�Ȼ��Ʒ�����������IJ�Ʒ���ж��ռ�飬���ȽϽ������Ҫʱ�Ƚ��в�Ʒ�����ȶ��ԵĿ��飬��������Ҫ���߿���Ϊ�ϸõ�λ���ɳ�Ϊ����ҵ�ϿɵĹ�����λ��������������Ӧ����ƽ����ʱ�����ϲɹ�����ͨ����
���ϲɹ����Ŵ���������������ƺϸ�ĵ�λ�ɹ�ԭ���ϺͰ�װ���ϡ�
1. ������λ����� ������λ���������Ӧ���ڽ��У�ͨ��Ϊlһ2�����һ�Ρ���������λ���Ʒ�����йص���Ҫ���ط����䶯���п��ܶԱ���ҵ�IJ�Ʒ���Ӱ��ʱ������ʱ��������顣
2. ������λ�ĸ��� ÿ�����Ͼ�Ӧѡ��2��3��������ƺϸ�Ĺ�����λ��
��Ӧ��ȷ����һ�㲻��������������Թ�����λ�ṩ�����ϳ����������ϵ�Ͷ��(����ԭ����ԭ����ԭ���)�����г��仯�и����ʵĹ�����λ����ʱ�������������Ż����ϲɹ����ſ�����������������۵�Ҫ�����밴������λ������Ƴ����������������Ż�ͬ���ϲɹ����ţ�����ȷ���µĹ������ۡ���ҩ�ĵIJ���Ҫ��Թ̶���
�ɹ�����ԭ��ҩӦ�пڰ�ҩƷ�������ļ��鱨�档
������ �ֿ�����Ϲ���
һ��ԭ����
1������ ԭ���ϵ����ֿ�����˸��𰴹涨���г������ա�ԭ����������ʾ��Ʒ����������������š�������λ������Ӧ�빺����ͬ��������λ���ṩ�ļ��鱨�浥�ϵ�����һ�¡����ϵİ�װӦ���ܳ������𡢳������������ϵı�ǩӦ��ã���ʾ����Ӧ�淶��ȫ��������������Ҫ��ģ��ֿ���Ȩ�����Ծ��ա�
�����ͬ���ջ���ԭ�����ɲֿ������ҵ�ı��ԭ�����ͳһ��ţ��Ա����ҩ����ķ���ΪĿ�ġ������ŵ�ԭ���ϣ��ɲֿ�������ű���ԭ���Ա����ţ�����������ţ�Ȼ����дԭ�������ϼ�¼��ԭ�������˼�ԭ���Ͽ��
�Խ���ԭ���ϵ����װ���������������涨������ţ�������־����ʱ��дԭ�������鵥����ͬ������λ��ڰ�ҩ�����ļ��鱨�浥һ�������������ų������顣
2������
(1)�ʹܲ��Žӵ�ԭ�������鵥����ȡ��Ա��ȡ������ȡ����ȡ�������·�ã���������������ȡ��֤������дԭ����ȡ����¼��
(2)ԭ���ϵ�ȡ������ȡ���һ�ȡ�������У��价���ྻ����������������ͬ��ԭ�����͵�ȡ����ǰ��Ӧ���ʵ��ķ�����ԭ���ϵ����װ������࣬��ȡ�����ڣ�ͬһʱ��ֻ�ܶ�ͬһ���Ž���ȡ��������������ȡ������Ҫ������࣬Ҫ���ʵ��ķ�ֹ������Ⱦ�Ĵ�ʩ��
(3)ȡ��Ա������Ʒ�ֳ����ݣ��ֱ�����ȡ����ǩ������Ӧ����Ʒ����������������š�������λ�ȣ�����Ʒ�����鵥���������ṩ�ļ��鱨�浥������������Ա���ֱ���ԭ������������ѧ������������飬����������¼������Ӧ��������ҩ���������ں�һ�꣬�����ڵ���ҩӦ����3�ꡣ
(4)���ݼ��������ʹܲ�����ֿ��´�ԭ�����ϼ��鱨�浥����������ļ������źϸ�֤�ϸ�֤���ɲֿ���Ա������ճ�����������ʵ���λ�á�
3�����
(1)�ֿ����Ա���ݼ�������������������Ӧ�ϸ�Ʒ���ϸ�Ʒ������ɽ�������־����������Ϻϸ�����״̬��־����������£�Ҳ�ɲ�ȡ�����ܷ�ֹ���ú���Ϊ����Ĺ�����ʩ��
(2������ϸ��ԭ���ϣ�������д���ԭ�����ϴ�λ���ͷ����ˣ���¼�շ���������
(3)���ϸ�ԭ���ϣ�Ҫ�����ϸ�ԭ���ϴ����������ƴ���������������������������ʹ�û��˻������ľ��������������ϸ��Ʒ̨�ˡ�
(4)ԭ���ϲ���¶���ţ�¶��ѷ��������⡢ˮ���������硢�桢�����Ȼ��������ʴ��ʹԭ����ù����ʡ�
(5)ԭ����Ҫ���װ���ϡ���Ʒ�ֿ���������������Һ��ԭ��Ҫ�ֿ������ӷ�������Ҫ�з�ֹ��Ⱦ�������ϵĴ�ʩ��
(6)����ȼ�ױ������Դ�ʴ��ǿ��Σ��Ʒ��Ӧ����Σ��Ʒ�⣬���ϸ�ִ�й����й�Σ��Ʒ�����䡢���桢ʹ�õİ�ȫ�����涨��
(7)����ҩƷ������ҩƷ������ҩƷ(����Լ��)����ϸҩ�ġ�������ҩƷ�����ա����桢���ܡ����š�ʹ�á����٣�Ҫ�ϸ�ִ�й����йع涨��
(8)�����ֵ����ա����桢���ܡ�ʹ�á�����Ӧִ�й����й���ҽ������ֱ��ܵĹ涨��
(9)���¡�ʪ�Ȼ���������������Ҫ������ϡ��м��Ʒ�ͳ�Ʒ�������涨�������棬�����òֿ��¡�ʪ�ȼ�¼��
(10)���ơ������ӹ���ľ�ҩ��Ӧʹ������������װ������ĩ�ӹ������Ƶ�ҩ���ϸ�ֿ���
(11)��ͬ��ԭ����Ӧ�������ȶ���������ֱ��ƶ������ڣ�һ�㲻�������꣬������Ӧ��������ȫ��죬�ϸ��߲���ʹ�ã���ִ�и�����������Ĺ涨��ԭ���������ڼ䣬���Զ��ڳ������飬�Ӿ�������������¡������»�ʮ�����³��һ����
(12)�����Ӧ������ͨ�����ã������桢��ù���������࣬����Ķѷš���ǽ����ء����м䶼��������һ�����룬�Ա������������������ִ�����Ƚ��ȳ����ķ���ԭ��λ���ܵĻ������������Ӧ�ò�ͬ��ɫ������������ʾ��
(13)һ����ҩ���������ܳ�����ù�����������˳����ر�ע������⣬��Ӧ���ʵ��ķ�ù����������ʩ����ù����������ʩ����Ӱ����ҩ�ĵ�Ʒ�ʡ�
ҩ�ļӹ�ǰӦ������ʺͷ�ҩ�ò�λ���������������飬��ҪʱӦ�����������ա������������Ͷ��ӹ���
Ҫ�ƶ��ֿⶨ�����������ƶȼ�����������̣���������������¼��������ʵʩ�����ڴ����ҩ�ģ�ÿ���굹��һ�Σ������������ҩ�ġ�ù������������ɹ��ù�����ҩ�ģ������������⣬�����������������ţ������ϸ�ԭ���ϴ�����
4������
(1)����ԭ�ֿⰴ����ָ��������������ϵ��������š�����ԭ���ϱ����Ǻϸ�Ʒ�����ϸ�ԭ���ϲ��÷��š�
(2)�ֿⰴ������д���������ϵ����ϡ��ֿ�����ԭ���ϱ����װ��ã��кϸ��־����ԭ���ϼ��鱨�浥�����ϵı�ǩ���־Ӧ������һ�¡��ͷ���ʱҪ��`���������Ƚ��ȳ������涨Ҫ���������������д�ֿ������¼����
(3)����Ա��ֿ����Ա�˶�ʵ���ԭ�����͵���������ָ���ص㣬����Ա��������������Ա���������ļ��˶�ԭ����Ʒ����������š�����������ϸ�֤�ȣ����ϡ����ϡ������˾�Ӧ���������ϵ���ǩ����
Һ�����ϵķ��ϣ����������ϵ�����ԭ���������������š����ϡ��������������������������������ϵ���ǩ����
��������У���������Ҫ�ӱ����֡�
(4)ÿ�η��Ϻֿ����ԱҪ�ڿ���λ����̨�����������ȥ�������������Ƽ�Ʒ�֡����ŵȣ��Ա��ݡ����ԭ����Ӧ�����̴棬��дԭ�������̴汨����
(5)װ�������ڵ�ԭ���������������ʱ��������Ӧ�������ϱ����췢���嵥������ʱҪ���˴��������в����Ӧ����ԭ��
Ϊ�˱����ڶ�δ�װ������������Ⱦ��ӦҪ��ҩƷ������ҵ������������ྻ������ͬ�Ļ����½��г�����
(6)�ױ��ʡ�����������Ⱦ��ԭ������ʹ��ǰ�������涨�����ڵ�ԭ���ϣ�δ�涨ʹ�����������������ԭ���϶�����������죬�ϸ�ɷ��š�����ϸ��ԭ���ϣ�Ӧִ�и����������ڹ涨���������������������Ӧ��ʱ���졣
(7)����ҩƷ������ҩƷ������ҩƷ��������ҩƷ�ķ��š�ʹ�ã�Ӧִ��˫��˫����ר�˹���������ʱ���ü�¼����¼����Ӧ������ǩ�֡�
������װ����
ֱ�ӽӴ�ҩƷ���ڰ�װ���������������������ҩƷ�����ã���������ʲ��û��ܵ���Ⱦ����ô���ְ�װ���Ϸǵ���������ҩƷ�����ã��������ҩƷ�����Ⱦ��Ӱ��ҩƷ������
1������
(1)��װ���Ͻ����ɲֿ����Ա��������ͬ�˶Ժ���װӦ���ܳ������𡢳����ȣ����ϱ�ǩ��ã����ݹ淶���������ơ����������������λ���빺����ͬһ�£������й�����λ�ļ��鱨�浥��ϸ���������װ�����������Ƽ�飬����Ҫ����⡣
(2)������װ���ϵ��ջ�����⡢����ȳ���ͬԭ���ϵ���س���
2������
(1)�ʹܲ��Žӵ���װ�������鵥����ȡ��Ա�������취ȡ����ȡ�������·�ã�����ȡ��֤����д��װ����ȡ����¼��
(2)ȡ��Ա����Ʒ�����鵥�빩���ļ��鱨�浥���йؼ�����Ա��
(3)���ݼ��������ʼ첿����ֿ��ʹ��װ���ϼ��鱨�浥����������������źϸ��ûϸ�֤��
3�����
(1)�ֿ����Ա���ݼ��鱨�浥�����������־�����������˺ϸ����ϸ��������ڻ����ϱ��Ϻϸ����ı�־�����������Ҳ�ɲ�ȡ�����ܷ�ֹ���ú���Ϊ����Ĺ�����ʩ��
(2)�ϸ�İ�װ���ϣ�������дԭ�����ϻ�λ���ͷ����ˣ���¼�շ�����������װ���ϲ���¶���š�
(3)���ϸ��װ����Ҫ�����ţ������ϸ�ԭ�����ϴ����������ƴ�������ʱ�˻ع�����λ�����١�
(4)ֱ�ӽӴ�ҩƷ�İ�װ���ϡ�����(�����ϼ����ĵ桢������)����������ҩƷ��������ѧ��Ӧ����������������Ǩ�Ƶ�ҩƷ���У��Ա�֤���ﰲȫ��ҩ�����յ����װ�������ܣ�����������Ⱦ������������档���û���ʹ��ֱ�ӽӴ�ҩƷ�İ�װ���ϡ�
(5)���Ի���ʹ�õ��������밴�����ƶ�����ϴ��������⣬������Ҫ���Ҫ�˻���ϴ��
(6)ӡ��Ʒ�����̱�ȱ�ǵ�ӡˢ��װ����Ӧר���ר���ţ�Ӧ��ͬ��ǩ��������ʲ���ʹ�û���鲻�ϸ�ʱ��Ӧ�����Ų���ʱ��������ҪʱӦ���ٻ�Ĩȥ��ǡ�������ҩƷ������ҩƷ������ҩƷ��������ҩƷ�İ�װ������Ӧ�����Ե���Ӧ��־��
(7)�����ڰ�װ���Ϻ������������ڶ�����ͬ����ȷ��װ���ϵ�����Ҫ�����������Ŷ��ڰ�װ���������ͽྻ�̶ȵ���ߣ�Ӧ������չ�ⶨ�ڰ�װ�����ϸ�����������Ĺ�����
(8)ѡ�õ�ҩƷ��װ�����ʺ�ҩƷ���ǵ�Ҫ�������桢�����ʹ�ã��������װѡ�ò��������ҩƷ������й©�����⡢�绯��������ҩƷ������ѧ��Ӧ���±��ʡ�
4������
(1)����������Ա��ָ���д�������ϵ������ֿⱸ�ϡ�
(2)�ֿⷢ�ŵİ�װ���ϱ����кϸ��־���м��鱨�浥��������Ա��ֿ����Ա�˵�Ѱ�װ������������ָ���ص㣬������룬�ɳ�������Ա���ա����ϡ������������˾�Ӧ���������ϵ���ǩ����
(3)ÿ�η����Ϻֿ����Ա��Ҫ�ڻ�λ����̨������д����ȥ���������������Ӧ�����̴棬��дԭ�������̴汨�浥��
������Ʒ
1������
(1)�ֿⰴ�ʹܲ��ŵij�Ʒ���鱨�浥���������ŵij�Ʒ��ⵥ���ճ�Ʒ��������ݰ�����Ʒ��������š����š���������Ч�ڵȣ��緢�ָ�����Ʒ���κ��ɵ�Ļ�����ʱ������������ϵ��
(2)ͬ�����յĺϸ��Ʒ��ֱ����д��Ʒ������ˡ���λ����������ɫ�ϸ��־��
(3)���ڼ������Ҫ�Ĵ�IJ�Ʒ��Ӧ��ָ��λ�ø������־���ϸ�Ʒת��ϸ�����ţ���ɸ�������ɫ�ĺϸ�״̬��־�����ϸ�Ʒ�������ָ����λ�ã����ò��ϸ�Ʒ״̬��־�������ϸ�Ʒ�����������ƴ��������������ϸ�Ʒ̨�ˡ�
2�����
(1)��Ʒ��Ʒ�ַ��ࡢ������ţ��߶����У�����������
(2)��Ʒ���ʱ����ء���ǽ�����м��������һ�����룬�Ա�ִ�����Ƚ��ȳ�����ԭ�ϸ�ij�Ʒ���ô�Ӧ���ó�Ʒ����λ���������д��š�Ʒ�������š���������Ч�ڡ����鱨�浥�š��������ڡ��ͻ����ơ��������������������Աǩ���ȡ�
(4)������ִ������г�Ʒҩ��������֪ͨ�ֿ����Ա������һʽ��������ı���������ϸ˵����
(5)����ҩƷ��ϵ���Ч�ڣ��Լ�������Ч�ڵij�Ʒ���ֿ����ԱҪ��ǰ��ֿ����α��棬�ֿ��������������۲�����ϵ���������ƴ�����
(6)������ԭ����˻صij�Ʒ����������Ч���ڣ��������������ż���ϸ������⡣
(7)��Ϊһ�䣬������Ӧ�����Ե����ű�־����ͬƷ�ֵ����䲻�û�š�
(8)��ij����Ʒ���Ϊ��ʱ����������Ʒ�Ŀ���������������ţ����������С�
���Ľ� �������ŵ����Ϲ���
һ��ԭ���ϡ���װ����
1������
(1)��������Ӧ������ָ���ֿ�������ԭ���ϡ���װ���ϡ�
(2)�������Ų���ԱӦ�������ϵ��˶�ԭ���ϡ���װ���ϵ�Ʒ����������š�������������λ��ֻ�а�װ��ò����кϸ�֤�ſ��ջ���
(3)�����õ�ԭ����Ӧ��װ���ܣ���־���ԣ������װ����б���Ʒ������������������ŵ�ƾ֤��
(4)ȷ�Ϸ���Ҫ���ԭ���ϡ���װ���ϣ���д�����������ϼ�¼��
2�����
(1)�����������õ�ԭ���ϡ���װ���ϣ�Ӧ�����ù���Ҫ���Է����ڲ�ͬ�Ĵ��������Ʒ�֡�������ŷֱ�ѷţ����������Եı�־�������Ӧ��ࡢ���������Ⱦ.
(2)ȷ�����������ŷ��õ���Ҫԭ���ϡ���װ���ϣ���������Ӧ�߱���Ӧ�����������������ü�¼�����ݰ���Ʒ�������š�����������ʣ����Ա��������λ�ȡ��������˳��������ʹ�������ֱ������ҵӦ���й涨��
(3)Ϊ����ԭ���ϡ���װ���ϵ����װ�ϵij�����������Ⱦ����������Ӧ��ָ���ص��ȥ���װ�����ڲ��ܳ�ȥ���װ�����ϣ�Ӧ��ȥ���泾�������øɾ�����ܽ�����������
3��ʹ��
(1)ԭ���ϡ���װ����ʹ��ǰ���辭�˶�Ʒ����������š������������������״��������λ����д��Ӧ��ԭʼ��¼��
(2)���������������������ŵ���װԭ���ϣ�ÿ������ʹ�ú�ʣ���ɢװԭ����Ӧ��ʱ�ܷ⣬�ɲ�������������ע���������ڡ�ʣ��������ʹ����ǩ������ר�˱��ܻ��˿⡣�ٴ�����ʹ��ʱ��Ӧ�˶Լ�¼��
(3)���ݲ�Ʒ�IJ�ͬҪ���ƶ�����ǰС�������ƶȡ����Ƽ���ԭ��ҩ��Ʒ������Ӱ���ԭ���ϣ��ڻ�Դ�����š����ı�ʱ��Ӧ���б�Ҫ������ǰС�����ƣ���ҪʱӦ������֤��ȷ֤����Ҫ�����дС�����ƺϸ浥�����йز�������ǩ�����Ͷ��������
(4)ӡ��Ʒ�����̱�ȱ�ǵİ�װ���ϣ�Ӧ��ͬ��ǩ������
(5)�������Ŷ����ϵ��ݴ桢���š����ÿɲ��ղֿ����Ϲ����йع涨ִ�С�
��������װ��Ʒ
����װ��ƷӦ�����ڹ涨����������־��д��Ʒ����������š��������ڡ���������������Ҫ��ɽ����װ����
���������Ʒ
(1)��װ�õIJ�ƷӦ���ڴ��������������������ʹܲ������Ʒ���鵥�����ʼ첿�Ž��г�Ʒ���飬ȷ�Ϻϸ��ǩ����Ʒ���鱨�浥��
(2)���鲻�ϸ�IJ�Ʒ�����������в��ϸ�Ʒ�Ĺ����涨������
����� ��ǩ��ʹ��˵����Ĺ���
һ������Ҫ��
(1)��ҩ��װ����ǩ��˵������밴�ա���ҩ��ǩ��˵��������취����2002��ũҵ����22����涨��Ҫ��ӡ�ơ�ʹ�á�
(2)��ҩ��ǩ��ʹ��˵������ӡˢ�����ݶԲ�Ʒ�ı���Ҫȷ����������ȫ��������ҩ���ô��⣬����ӡ�и��ֲ��ʵ�������Ʒ�����ֺͱ�ʶ���������Ҽ�����ҩ����������ԭ�Ϸ�װ����������������������Ʒ��������Ʒ���������չ�˾���������������ִ��Ƽ����ȡ�
(3)��ҩ��װ�ڲ��üд��κ�δ�����Ľ��ܻ�������Ʒ����ҵ�����֡������������ϡ�
(4)��ҩ��ǩ��˵������밴����ҩ��Ȩ�ޣ���ũҵ����ʡ��������ҽ�������������������ʹ�á����ݱ��ʱ�밴ԭ�걨������������������
(5)��ҩ��ǩ��˵������밴��ͳһҪ��ӡ�ƣ������ּ�ͼ���������Լ����κ�δ�����������ݡ�
(6)��ҩ��ǩ��˵��������ݱ�����ʵ��ȷ��������ٺͿ��Ҳ����ӡ���κδ������������ɫ�ʵ����ֺͱ�ʶ��
(7)��ҩ��ǩ��˵��������ݲ��ó�����ɾ���涨����Ŀ���ݣ�����ӡ��ĩ������ר������ҩGMP���̱�ȱ�ʶ��
(8)��ҩ��ǩ��˵�����������ֱ��������ģ���ʹ�ù����������ֹ���ίԱ�ṫ�������й淶�����֡�������Ҫ�������Ķ��ա�
(9)������Ҫ����ҩ��ǩ�Ͽ�ʹ�������룻�Ȼ�����ר����Ʒ���ɱ�ער����Ǻ�ר���ţ�������ר���������ࣻע���̱�Ӧӡ���ڱ�ǩ��˵��������Ͻǻ����Ͻǣ�������ҩGMP�ϸ�֤�ģ����밴����ҩGMP��ʶʹ���йع涨��ȷ��ʹ����ҩGMP��ʶ��
(10)��ҩ��ǩ��˵������ּ����������ױ棬���ñ�ʶ������ҩ��ʶӦ�����Ŀ��������ӡ�������ճ�����ε�����������ճ�������еķ�ʽ�����Ļ䡣
(11)��ҩ��ǩ��˵�������ݶԲ�Ʒ��������;��Ŀ�ı�������Υ��������ҩ���Ĺ涨����������������Ч��Ӧ�÷�Χ�����ݣ����÷���������ͣҩ�ڡ���Ч�ڵ���Ŀ���ݱ����뷨����ҩ��һ�£���ʹ�÷�����ҩ���ұ�Ҫ��Ĺ淶�����
(12)��ҩ��ǩ��˵�����ϱ����ʶ��ҩͨ�����ƣ���ͬʱ��ʶ��Ʒ���ơ���Ʒ���Ʋ�����ͨ��������д������֮��Ӧ��һ����϶�����С�ͨ����������Ʒ�������ֵı�������С��1��2(ָ���)��������С��ע���̱����֡�
(13)��ҩ��С���۵�Ԫ�İ�װ����ӡ�л����з������װ��ǩ�涨���ݵı�ǩ������˵���顣��ҩ���װ���ϱ���ӡ�л�ճ�������װ��ǩ��
(14)��ҩ��Ʒ(ԭ��ҩ����)����ͬʱʹ���ڰ�װ��ǩ�����װ��ǩ��
(15)�ڰ�װ��ǩ����ע�����ñ�ʶ����ҩ���ơ���Ӧ֢(����������)������/��װ������ĺŻ�����ҩ�Ǽ�����֤��֤�š��������ڡ��������š���Ч�ڡ�������ҵ��Ϣ�����ݡ���ƿ������ƿ��ע����ڷ���Ʒ���ڰ�װ�ߴ�����ƶ���ע������ȫ�����ݵģ����ʵ�������Ŀ�������������ҩ���ơ���������������š�
(16)���װ��ǩ����ע�����ñ�ʶ����ҩ���ơ���Ҫ�ɷݡ���Ӧ֢(���������Σ����÷���������������װ������ĺŻ�����ҩ�Ǽ�����֤��֤�š��������ڡ��������š���Ч�ڡ�ͣҩ�ڡ����ء���װ������������ҵ��Ϣ�����ݡ�
��17������ԭ��ҩ�ı�ǩ����ע����ҩ���ơ���װ����������š��������ڡ���Ч�ڡ����ء����ĺš�����ע�������������ǡ�������ҵ��Ϣ�����ݡ�
��18)������������Ҫ��ı����ڱ�ǩ����Ŀλ�ñ�����
(19)��ҩ��Ч�ڰ�����˳���ע���������λ����ʾ���·�����λ����ʾ��������Ч����2002��09������������Ч����2002��09����
(20)���û�ѧҩƷ�������ز�Ʒ�ĵ��������������������Ƽ���˵�������ע���������ݣ����ñ�ʶ����ҩ���ơ���Ҫ�ɷݡ���״��ҩ�����á���Ӧ֢(����������)���÷���������������Ӧ��ע�����ͣҩ�ڡ�����ɱ��ҩ��������������ж��к��ķ�����װ�Ĵ�����ʩ����Ч�ڡ�������װ������ء����ĺš�������ҵ��Ϣ�ȡ�
(21)����ҩ˵�������ע���������ݣ����ñ�ʶ����ҩ���ơ���Ҫ�ɷ֡���״�����������Ρ��÷���������������Ӧ��ע�������Ч�ڡ�������ء����ĺš�������ҵ��Ϣ�ȡ�
(22)����������Ʒ˵�������ע���������ݣ����ñ�ʶ����ҩ���ơ���Ҫ�ɷּ�����(�͡��꼰���������ͻ�������ζ�)����״�����ֶ����÷�������(�������������ϡ�ͷ���)��ע������(����������Ӧ�뼱�ȴ�ʩ)����Ч�ڡ����(������ͷ��)����װ�����ء�������װ������ʩ�����ĺš�������ҵ��Ϣ�ȡ�
(23)��ҩ���Ƶ�ʹ��Ӧ����ũҵ��ũ�շ�[1998]3���ġ����ڼ�ǿ��ҩ���ƹ�����֪ͨ�����йع涨��
(24)�ڰ�װ��ǩ�����װ��ǩ���ݲ��ó���ũҵ���͵���ũ���������ܲ���������ҩ˵�������������ݣ����ֱ���Ӧ��˵���鱣��һ�£�Ӧ�����л��������ҹ�
������ǩ��ʹ��˵����Ĺ���
��1��ҩƷ�ı�ǩ��ʹ��˵�������ݱ������ũҵ�������ġ���ҩ��ǩ��˵��������취�����йع涨�������������������ܲ����������ݡ�ʽ����������һ�¡��ʹܲ���Ӧ���������ַ����ʼ졢�������ֿ⡢�����Ȳ�����Ϊ���պ˶Ա���
��2����ǩ��ʹ��˵����������ֿ�Ӧָ��ר�˰���ҵ��������顢��ۡ��ߴ硢ʽ�� ����ɫ���������ݡ�Ӧ������������ȷ����������Ҫ��ĵ�����棬�ֿ�ָ��ר�����٣����������ǩ�������ü�¼��
��3���ʹܲ���Ӧ��ÿ����ǩ��ʹ��˵�������������ϸ�˶ԣ�����Ҫ���ǩ���ϸ�֤�������ü�¼��
��4�����ʹܲ������պ�ۺ�ǩ��ʹ��˵������밴Ʒ�֡�������ŷ��࣬ר�⣨ר��ţ�����������ר�˹�����
��5��������ҩ��ǩ��ʹ��˵����Ӧ����װָ�����������ŵ�ר����ȡ���ֿ����Ա��������д�����ϵ���������ţ�����д��ǩ��ʹ��˵���鷢�ż�¼���졢�����˾�Ӧ���������ϵ���ǩ����
��6����������ר����ȡ��ǩ��Ӧ����ҵ���������˶����ݡ����������ţ������ӡˢ�������������ռ�¼�������𱣹ܡ���ǩ��ʹ��˵�����˰�Ʒ�֡�������ŷ��࣬����ڰ�װ�����ݴ�ר�����������ܣ����ó��������ʲᡣ
��7����Ʒ��ǩ������ר��������������ȡ��ǩ��ʹ��˵���飬�������Ÿ��ݰ�װָ����м�Ʒ����ϸ���������ţ�����д��ǩ��ʹ��˵���鷢�ż�¼��
��8����Ʒ��ǩ����Ӧ���ǩʵ�����������ʵ��������������ʣ����֮�����������������ʱ��Ӧ�������ԭ���������ü�¼��д��ƫ��档
��9�����ϸ��ǩ��ʹ��˵���鲻���˻�ӡˢ���������ϸ�Ʒ�����������ƹ�������ʱ���١���ǩ���ø������û�Ϳ�ĺ����á�
��10���������Ż���ǩ����ʣ���ӡ�����ż�����ı�ǩ�������˻زֿ⣬Ӧָ�����˸������٣����������ټ�¼��
��11����ӡˢ��ӡ�����ŵı�ǩ����ʣ�������ȡ��ʱ���ֿ�Ӧָ��ר�˼�ʱ���٣���Ӧ���ü�¼�����ɼ��������ǩ����
��12��ӡ��Ʒ�����̱�ȱ�ǵİ�װ���ϣ�Ӧ��ͬ��ǩ��ʹ��˵���飬����ǩ��ʹ��˵�����������ӦҪ������йع涨�ƶ������취��
��13��ӡˢҩƷ��ǩ��ʹ��˵�����ģ����δ��ֹʹ��ǰ����ҵӦ��ȡ�ϸ��ʩ��ֹ��ǩ��ʹ��˵������������ģ��Ҫ��̭����ҵӦ�ջغܻ������
��������ҩ�ĵĹ���
һ����ҩ�ĵ�����Ҫ��
��1�� ��ҩ�ĵ�������Ӧ���ϡ��л�������ҩ�䡷�Ĺ涨�����л�������ҩ�䡷δ���ص�Ʒ������ҵ�����������š����ʲɹ����š��������Ű���Ʒ����Ҫ���Ӧ�ƶ���
���������⣬���е���ҩ�Ļ�Ӧ�ð���Ʒ�������֧ͷ���ƶ��ȼ�������ҪʱӦ������ҩ��ʵ��걾����Ϊ������ҩ����α���ӵ����ݣ�����ȷ��Ч�ɷݺͲⶨ��������ҩ�ģ���ҵӦ�ƶ����ԡ��������ڿر��������ж��к����ʽ�����������Ҫ��
��2�� ��ҩ�ĵ����ƣ�������ϡ����ƹ�̡��Ĺ涨������ȷ��Ч�ɷֺͲⶨ����������Ʒ����ҵӦ���ƶ�������֯��ѧ�Ķ��ԡ��������ڿر���
��3�� �ޱ��Ļ���鲻�ϸ��ҩ�IJ�������������
������ҩ�ĵIJɹ�
��1�� �ɹ�������ҩ�Ŀ�������й�ҩ���������Ž����̶��ij��ڹ�����ͬ��ʱ��Ӧ��
��2�� δ�ӹ����Ƽ�����ҩ�ģ�Ӧ�ɾ������̹������š�ҩ�����ź����Ͽɵ���ҩ���������Ż����в����롣
��3�� ��ҩ�ĵIJ��ز�ͬ����ɷ�ҳ������ͬ���ɷݸı��ֱ��Ӱ��ҩЧ����˹�ʱ����ʮ��ע�⣬��ͳ��Ʒ���ѡ�ù̶����ص�ҩ�ġ�
��4�� ��ҩ�ĵ�����ȫ�����ز�����ͬ����Щ������ͬ����ͬ�֣���ͬ�ֲ�ͬ������˲ɹ�ʱӦע����������Ҫʱ�������ı�ע������ÿ����װ��ע����
��5�� �������ҩ��Ӧ������İ�װ��ÿ���϶�Ӧ����Ʒ�������ء����ڡ�������λ�ȡ�
��6�� �������ҩ�����������ϸ�֤��
������ҩ�ĵ�����
��1�� �������ҩ�ı����ɼ�����Ա��ҩ����ҩ�Ĺ������飬�����ݰ�����װ�Ƿ������������ܳ�����ù����������α���𣻱���ʱ�ñ걾�����ա�
��2�� ����ϸ����ҩ�IJ��������鲢���涨�������ţ�����������š�
��3�� ������ҩ��Ӧ���涨�ij�������������顣����ϸ��߷�������ҩƷ������
�ġ���ҩ�ĵ������뷢��
��1�� ��ҩ�ĵ����淢��������ԭ���ϵ����淢��Ҫ����ͬ��
��2�� һ����ҩ���������ܳ�����ù�����������˳����ر�ע������⣬��Ӧ���ʵ��ķ�ù����������ʩ����ù����������ʩ����Ӱ����ҩ�ĵ�Ʒ�ʡ�
��3�� ҩ�ļӹ�ǰ��Ӧ������ʺͷ�ҩ�ò�λ���������������飬��ҪʱӦ�����������ա������������Ͷ��ӹ���
��4�� ���ƺ������ӹ���ľ�ҩ��Ӧ���а�װ��ר���ר�����棬�������Եı�־����ҩ�IJ�����δ�ӹ����Ƶ�ҩ�Ļ�ţ���ҪʱӦ�п����¶ȡ�ʪ�ȵ���ʩ��
��5�� �綾ҩ�����װӦ�����Ա�־������ר��ר�Ᵽ�棬��֡�˫��˫�����ļල�����ƶȡ�
��6�� Ҫ�ƶ��ֿⶨ�����������ƶȼ�������̣���������������¼��������ʵʩ�����������ҩ�ģ�ÿ���굹��һ�Σ������������ҩ�ġ�ù������������ɹ��ù�����ҩ�ģ������������⣬�����������������ţ������ϸ�ԭ���ϴ�����
��һ ���¹����ļ�Ŀ¼
1.����Ԥ���ƶ� 2.���ϲɹ��ƶ�
3.��������ƶ� 4.���ϱ���ƶ�
5.���ű����ƶ� 6.ԭ���ϲֿ�����ƶ�
7.��װ���ϲֿ�����ƶ� 8.��Ʒ�ֿ�����ƶ�
9.Σ��Ʒ������ƶ� 10.�����ֲֿ�����ƶ�
11.������ҩƷ�ֿ�����ƶ� 12.��ҩ�Ĺ����ƶ�
13.ȡ�������ƶ� 14.���������ƶ�
15.�ֿ���ʪ�ȿ��ƹ����ƶ� 16.�ֿ�������������ƶ�
17.���ϸ����ϴ����ƶ� 18.�˻ز�Ʒ�����ƶ�
19.ʣ�������˿��ƶ� 20.��������̴��ƶ�
21.���ϸ����ڹ����ƶ�
���� ���¼�¼����Ŀ¼
����5��1 ���ʽ������������¼ ����5��2��Ʒ���ۼ�¼
����5��3��Ʒ�˻���¼ ����5��4��װ���Ͻ�������
����5��5ԭ���������ϼ�¼ ����5��6����ԭ��������
����5��7ԭ���������鵥 ����5��8�ϸ�֤
����5��9���ϸ�֤ ����5��10���ԭ�����ϻ�λ��
����5��11����ԭ�����Ϸ�� ����5��12���ϸ�Ʒ̨��
����5��13�ֿ��¶ȡ�ʪ�ȼ�¼ ����5��14�������ϵ�
����5��15�ֿ������¼ ����5��16ԭ�������̴汨�浥
����5��17��Ʒ��ⵥ ����5��18��Ʒ�������
����5��19��Ʒ����λ�� ����5��20�����������ϼ�¼
����5��21��Ʒ���鵥 ����5��22��ǩ��ʹ��˵���鷢�����ü�¼
����5��23��ǩ���ü�¼ ����5��24��ǩ���ټ�¼
������ ����
����
��������������Ⱦ������ҩGMP����Ҫ����֮һ����ҩ������ҵ��������Ҫ������������Ʒ�ͷ����������Ӻ�������Ⱦ��Ʒ�����ԣ���ҩ������ҵ������������ʵʩ��ҩGMP����Ҫ���ڡ�
WHO���������µĶ����ǣ������塢��������ᴦ����ȫ���õ�״̬������ҩ������ҵ������״����������Ϊ�˱�֤��ҩ��Ʒ��������Ҫ������Ҳ��ӳ����ҵ�������̶��Լ�Ա���ľ�����ò��
����ҩGMP������������Ҫ��ָ����������������������������(�����豸��ԭ�����ϡ��������ʡ����ռ�����)����Ա������������������������������������¡�������������������������������һ����֮����ϵͳ���̡�Ϊ��ʵ��������������������������������������������IJ�ͬ����ֱ��ƶ���Ӧ�����������ƶȼ����������̣�����ר�˸���ලʵʩ����¼�浵��
���������½����漰�й��������ݣ��ڱ��²�������
��һ�� ����(����)����
����Ӧ�ϸ��յ����³�������ʩ���������Ҫ��ѡ��ַ����ó��ڹ滮�����Լ���������������������ҵ�����������ʱ���Ʒ���һЩʼ�ϲ����ı仯�������ص�Ӧ���ó��ڵĻ�������������ȫ��ְ�����������Խ�������������Ϊ���Σ������������Ĺ�������������һ����������Ĺ�����
�ڶ�������������
����һ��������(�ྻ�ȼ���Ҫ������)
(1)�������࣬�Ŵ�������ǽ�桢����ྻ������ۼ����ҳ����豸���ܵ����������������࣬�ҳ������ܡ�ð���Ρ�©��������࣬��������¼��
(2)�豸�����������߰��涨�Ĺ���Ҫ����ò�Ӧ������ϴ�����������
(3)���������������̣���ֹ���̵ı�־Ӧ���ԣ����б�Ҫ��Ӧ��ȫ������ֹ���̣������������ó�ʳƷ�����ʳ����ô���������ص���Ʒ��˽�������������¡���ֽ���ͺеȣ������������ݡ�
�����ྻ�ȼ���Ϊ��ʮ��ʮ����
(1)��Ӧ���ϡ�����������Ҫ���⣬�����ڱ��������豸�����������ߺܵ�������ࡣΪ�˱���ԭ���ϡ���װ���ϵ����װ�ϵij�����������Ⱦ����������Ӧ��ָ���ص��ȥ���װ�������ܳ�ȥ���װ�����ϣ�Ӧ��ȥ���泾�����øɾ�����ܽ��������������װ����δ�������ǰ���ý��˱�����
(2)�����ڵĿ���Ӧ���ϡ���ҩGMP���Ĺ涨��
�ʿز���Ҫָ��ר�˶��ڼ�鱾�������������ྻ�ȡ������¼�������
�����ྻ�ȼ���Ϊ���ټ�����
(1)��Ӧ����һ����������30��10���������涨��Ҫ���⣬�������ϸ�ִ�нྻ�������ƶȣ�
(2)�������ÿ��һ�Σ���Ҫ����У�
(3)��Ҫ���˽ྻ�ҵ�ԭ���ϣ���ȥ���װ��Ӧ��ֱ�ӽӴ�ҩ��İ�װ��������������Ҫ�������ϴ���������¼��
��4������Ʒ��ʱ�����뽻���ǽ�桢�ذ������������øɾ����Ӵ�ҩ�������������ϴ�Ӹɾ�����������ߡ�̨������ˮ��ϴ���������������ã�
��5���ྻ�Ҳ��ð�������������ÿ��������㹻ʱ����������������Ʒ��ʱҲ����������6Сʱ�ļ�Ъ��
�����������ݲμ���6��1��
�ġ��ྻ����������
�ྻ����Ӧ����������ʹ�õ����������ö��豸��ԭ�ϡ���װ���ϡ���Ʒ�Ȳ�����Ⱦ��������Ӧ�ֻ�ʹ�ã���ֹ����������ҩ������
Ϊ�˱�֤ҩƷ���������ӹ��Ľྻ����������״��ʼ�շ��ϡ���ҩGMP����Ҫ���뽨�����������ڽྻ����������(���)��̡�����(���)Ŀ����ɱ�������ʹ�ྻ�����ܹ����ַ��ϸ����ྻ����Ҫ���״̬��
1���ྻ��������(���)��� Ӧ���ٹ涨�������ݣ�
(1)����(���)�ķ�Χ��
(2)����(���)�ļ��ʱ����Ƶ�ʡ�
(3)����(���)������
(4)ʹ�õ���������
(5)�����������ơ�
(6)ÿ������(���)�����ѵ�ʱ�䡣
Ϊ�˷�ֹ�������Լ��������̱������豸��ԭ�ϡ���װ���ϡ���Ʒ�Ȳ�����Ⱦ����������������������ɺ���С�Ϊ�˷�ֹ������ҩ����IJ�����������Ҫ�ֻ�ʹ�ã�Ҫ�涨�ֻ������ڡ�Ƶ�ʡ�
2�������������� ��ҩ�����Ľྻ����������ҵ�ྻ��������ͬ���ر���������������Ҫ���ƿ�����һ�������״̬���������ӣ���Ҫ���������������ṩ����������(����)��
��ҩ�����ϻ���������ķ������¿��Է�Ϊ�����ࣺ
(1)���������ù��˽���(������������������Ч������)��������������г������Ӿ����Բ���������
��������Ӧ�õij��������������ǵ�һ�ģ��������ù�����������ַ����Ľ�ϡ����������Ŀ���(��յ�ϵͳ)�����ù��˽��ʳ��������Ծ�ֹ�����ڵĿ�����������������������ҡ������ҡ����ݴ����·��ȵ������
(2)�������������������������������䡢�������������ᡢ��ȩ���������������Ѭ���������������ȡ�
A���������������������ƣ�����Ҫ���ڽྻ����̨�������֡����ϴ��ݴ��������ҵȡ�
B�����������ྻ�ҵ�ǽ�桢�컨�塢�š����������豸������������̨�����������εȱ����Լ�����˫�֣����ף���Ӧ������ಢ��������������
�����õ������������ڲ�������̨�У���0.22����Ĥ���˺�ʹ�á�����(���)����Ҫ���м�¼����¼Ӧ������������¼��������(���)��¼Ӧ����������(���)�Ĺ��̡�����(���)������������(���)��ʱ�������(���)ִ���˵ȡ�

�塢�ֿ�����������
(1)�ⷿ�ڸ���ԭ�����ϼ���ƷҪ���涨�������ţ�Ӧ����������ȷ�����Ͻ���������桢ȡ���ߵ���ͨ�����ϱ�ʶ��ȷ����������ͨ����
(2)�ⷿ�ڻ��ܡ�������ڷ����룬���30cm����ǽ50cm���ڷŷ���Ҫ������������ࡣ
(3)ͬһ������Ӧ�ڶ��뼫�߶�Ҫ��Χ�ڵȸ߶ѷţ��������룬���࣬�����շ����������١�
(4)���ڲ��ô����������ÿ����ɨ�������������������������ŵ㡣
(5)ÿ����һ��������ɨ��������ǽ�棬����ݽ�Ҫ�ص���࣬������֩�������ڡ��Ŵ�����Ҫ����������Ŵ�����ϴ����ָĨ�������ҳ�Ϊ�ϸ�
(6)�ⷿ����ʱɱ����˿ⷿ���������С���
(7)�����Ŵ������ľ�ṹ�������и�������������
(8)���ϡ�������Ա�������ʱ���¡�Ь�������࣬�����ڿⷿ���⾻Ь��ʩ�ϳ���
��������
(9)�����������ϸ��������������У������������������������װ������²ſ�������ڡ�
(10)�ⷿ�صأ��Ͻ��̻𡣳�����ȡ�����λ�÷������������⣬���ڲ������κ����
(11)����Ӧͨ�����ã������¶ȡ�ʪ�ȡ���������ù��ͨ�細��Ӧ��ɴ���Է���Ӭ���롣������Ӧ�ش����ţ���ֹ��д���ɳ�����������ֹ���ʪ����Ⱦ���غ����ϡ�
(12)�ⷿ��ĵ�·(�����������̻�������)ɢˮ������Ϊ�ⷿ���������ɨ�������������涨��
������������������
(1)������Ӧ�ϸ�������롣���ݸ��Ҹ�ͬ������ƶ�������������������¼��
(2)���������õ��������DZ���ȡ������Ӧ��ʹ��˵���涨�ƶ�������ڲ��ϸ�ִ�У�������ϴ��¼��
(3)�����ҹ���̨��ҩƷ��Ӧÿ����ñ�����࣬Ӧ���ݸ��ҵ������Բ�����ϴ�����á�
(4)������ÿ�칤����ϣ�ʵ��������ϴ�ɾ���鸴ԭλ��������������࣬��ɨ��
(5)ÿ�¶Լ����ҽ���һ��ǽ�桢�Ҷ����ݽǡ������ߵ����Ŵ����ư��������Ŵ��͵ư�Ӧÿ�����һ��(���Ұ������ƶȰ���)��
(6)����ʢװ������������ڷ����롣���������࣬������水��ϴ�ƶ���ϴ��
(7)�������豸(��ʽ��¯�����ӽ�����ѹ��)װ��(���Ⱥ��¹ķ�����䡢���Ⱥ���������)Ӧ���������ࡣ
(8)��������Ա���涨�����ù���ñ��������ñ��Ӧ������ϴ����Ҫʱ��ʱ��ϴ��
(9)����������ϴˮ�ۡ���ͷ��ˮ��ÿ�������������Ӧ�ýྻ��ϴ�ɾ���
(10)�����Ҳ����ġ����ϡ����ʣ�Ӧ������Ҫ����д������ŷš�
(11)�����ҽ�ֹ���̡���ʳ����
������ ԭ����������
ԭ�����Ͻ���������������
(1)�ӿⷿ�����ԭ���ϰ�װӦ������Ⱦ���涣��ҧ������Ⱦ��ӡ���ܷ�������װ��òŵð�����ԭ�����Ѱ��䡣
(2)ԭ���������װ��װ��Ӵ��ݹ��ͳ�������(����ƽʱ����ԭ�����ݴ��)��װ���Ϻ�ԭ���ϴ��ݿ������ݹ����ţ����봫�ݹ���ϴ��ݹ����ţ�֪ͨԭ�����ݴ�乤����Ա��
(3)ԭ�����ݴ�乤����Ա�����ݹ����Ž�ԭ���Ͻӽ���رմ��ݹ����ź˶����Ͽ�Ƭ�����ڰ�װ˵����ȫ���ϲ��������������ԭ�����ݴ����á��ڰ�װҪ��75���Ҵ�����������
(4)��������װ���ԭ���ڰ�װҪ��װ������ƵĴ��ݴ�������30min��
(5)���ϸ��ԭ���ϼ������г��ֵķ�Ʒ��ԭ�����볡�ķ�˳���˳�������
���벻ͬ�ྻ����������ر��Ƕ������������������Ⱦ�����ϣ���ҪʱҪ����ר�ó���ڣ��ྻ�����ڵ����ϴ���·��Ҫ�����̡���Ա�����Ͻ���ྻ����Ҫ�и��Եľ������Һ���ʩ���������ҵ���ʩҪ��Ӧ���������Ľྻ��������Ӧ��
���ϵĻ�����Ӧ�ܶ������������������������нྻ��Ҫ���������������Ҫ������ࡣ���ڽ������������ϡ�����Ҫ��������˫��������������������ϵ����ʶ���������������������ѹ�������
���Ľ��豸����
����������ʹ�õ��ر���ֱ�ӽӴ���Ʒ���豸�����ߡ��������ܵ��Լ��������ߵĶ�������뱣����ʮ����Ҫ�ġ�
Ϊ�˱�֤����������ʹ�õ��豸�����ߡ��������ܵ����������ߵ������������ת�������ƶ���ౣ���ƶȺ�����̡�����ƶ��������Ӧ��������Ҫ������Ӧ��������ղ��������ע����������������йص��豸����ҩƷ�Ӵ����ֺ���ʹ�õ�����Ӧ�ﵽ����Ҫ��
�����е������豸Ҫ�ƶ��̶���������ڡ���������Ҫ�ۺϿ����豸��ʹ�õIJ��ϡ����������е�ҩ�����ʵ����أ����������̶�ͨ����֤��֤��û�в���ҩ��Ͳ���������
��������ÿ����ҩ����֮�佫�������豸�����������߲��ֻ�ȫ����ж�Խ���ȫ����ࡣ��������ʱ����Ҫ�ɲ�Ʒ�����ʶ�������ù�ط�װ�����Ƽ���ʹ�õ��豸�����������������豸��Ҫ��ÿ��֮���������ȫ������ͱ�����
���������ౣ�������ǽ��豸����������������ר��������ࡢ��������������̶����������뱣������Ϊ�����ƶ����豸����������Ҫ���Dz��ֲ�ж���ƶ����������ȥ���ܵķ��������һЩ���õ��豸�������������Ϲޡ���ϻ������(װ)����������������ض����Ѳ�ж�����Ҫ���ƶ���Ϊ�ϸ������ƶȺ���������ƶ�������ں���Ҫ������̶ȡ�
�����豸�������������ϵĹܵ����õȡ�Ҫ�����ܵ�û�����ǡ���ˮƽ�Ĺܵ�������ܵ����á������豸�IJ���Ҳ����Ҫ��һ��Ҫʹ�ù⻬�����������䡢������ʷ�Ӧ�IJ��ϡ���Ҳ��ҩƷ�����о������豸��������������ʹ�õıþ�Ӧ�ǿ����ġ��������Ʒ�Ӵ��ıã��ر�����������Һ��ıã�һ���Ӧ�ǿɲ�ж�����ıá����Ʒ�Ӵ��Ĺܵ���Ӧ�����ڲ�ж���Ա���ࡣ�ıÿ���������������࣬�ܵ��������ˮ���������д�����
����
����� �����
Ϊ�˱��ڶԳ������豸�����������ߡ�����������ʵʩ����̣����ƶ������ʱҪ��ϸ�涨���µ����ݣ�
(1)���Ķ����Χ��
(2)����(ֱ�ӽӴ��������յ��豸���������ܵ�������Ӧ����֤����
(3)������
(4)���ʱ��(���Ƶ�ʺ�����)��
(5)����õ��豸��
(6)ʹ�õ������������������Ʒ�����
(7)���ߵ���ϴ�����ʹ�ŵص㡣
(8)���̶Ⱥ�Ч�������ۡ�
(9)����������¼���������ڡ�������ǩ����
����Ʒ��ʹ�õ��豸�����������ߵ�����뱣�����ƶȺ����Ҫ������ݽ�������Ʒ��ʹ�õ��豸�����������ߵ����Ҫ���Ϊ�ϸ�Ϊ��Ҫ���ر������ղ�������IJ�Ʒ��ʹ�õ��豸�����������߳���Ҫ��Ҫ������⣬��Ҫ��֤�����ı����б�������Ӧ�ڳ������������������µ����ݣ�
(1)����ʢ������Ʒ������������������ע��������ڣ�
(2)������ҩ��Ӵ����豸���������������߱�����������ע��������ڣ�
(3)�������豸����������������Ӧ�ڹ涨��ʱ����ʹ�ã�
(4)��ʹ��ͬһ��Ʒ����������֮�䣬Ҳ�����������豸�����������ߡ�
������Ҫ���ij��������䡢��λ���豸�������Ⱦ�Ӧ��״̬��־���硰����ࡱ��
������ࡱ��
����

(��)����
������豸�빤�ߵĻ���Ҫ����Ҫ�ǣ�
(1)ʹ�ò�������ά�����IJ��ϣ�����ʹ��һ���ԵIJ��ϣ���������ϴ���������
(2)����������豸�빤�߲���ѡ��������������IJ��ϡ�
(3)��������������߲��û��ã�Ӧ��ÿһ������������ר�ŵ����������ң������Ա�ǣ�����Ӧ��ͨ�缰��������Ӧ����ʩ��
������ ��Ա����Ҫ��
������ҵ�������Ӷ�ȫ��ְ�������������������ѵ��
��Ա����Ҫ������Ӧ�����������ݣ�
1��һ��������
(1)����Ա����ÿ�����һ�Σ���������������������ݲ�����Ա������
(2)���д�Ⱦ�������Դ�Ⱦ���������߲��ô�����ҩ����������
(3)������Ա���ֲ���ֱ�ӽӴ���ʼԭ�ϡ�һ����װ���ϡ��м��Ʒ�����װ��Ʒ��
(4)������Ҫ����ϴ�衢�����������롢�����ס���ϴ�·������ָ�����ࡣ
2���ྻ��10��30������
(1)��Ӧ����һ����������Ҫ���⣬����Ƥ����(��ƤѢ����ָ��)�Լ������п�ȾӰ����ҩ�������ˣ����ô���ֱ�ӽӴ���ҩ��������
(2)ֱ�ӽӴ���ҩ����IJ�����Ա�����û�ױ������������ֱ������涨ϴ�֡����£���ñӦ��¶ͷ����������ñЬ�Ȳ��ô��뱾����
(3)���뱾�������Ա���������������ͼ3��2.
3���ྻ�Ȱټ���������
(1)��Ӧ�����������������Ҫ���⣬������ԱƤ�����������ˡ���֢������������ÿ��������ڡ����¡�
(2)�����������Ա�˴�������ÿ��Сʱ����һ���֡�
(3)���뱾������Ա���������������ͼ3��3.
���߽� �ྻ��������������Ҫ�����
һ��������װ(����ñ�ӡ����ס�����)����Ҫ��
(1)������С����������ά���䡢�ϴ�����
(2)���ײ������磬����𤸽���ӡ�
(3)���л���ý������ϴ�������������
(4)ϴ�Ӻ������ܱ���ƽֱ��
(5)���ȵ͡��������������ʣ�������������
(6)����ù��
������װ��
����������ʽ����Ӧ����ͬ�ྻҪ���������֣����ܻ��á�������Ա��������Ա������������Ա�ķ�װ�������𡣷�װ������6��2��
������װ��������
һ������������������ÿ��ϴ��2�Ρ��ྻ��10��30������ÿ2��ϴһ�Ρ�
�ຣ�Ȱټ�������ÿ�ϴ��
�ġ���װ��ϴ��
(1)ϴ��ǰҪ��鹤����ĥ���������������Ҫ���������������Ӵ��ж��к�ҩ��Ĺ���������ϴ��ǰҪ�������ƴ���(�����������)���Ա�֤��ȫ��
(2)ϴ�ӡ�����Ͱ�װ�������ķ���Ҳ�п��ƽྻ�ȵ�Ҫ��ԭ����Ҫ��ʹ�ù������Ľྻ�ҽྻ����һ�£������Ǹ�������������װ��Ҫ������
(3)�����������װ���������װ��������м���������������ʱ�䳬��2��ʱ��ʹ��ǰҪ���������
(4)���������������Ҫ���˽ྻ�����ϴ��ﱣ�档
�塢��װ�ı��ܺͷ���
��1�������������ҽྻ������ʹ�ù������Ľྻ�ҽྻ����һ�¡�
��2���������ɱ���Ա��ָ��ר�˷��š�
��3��������ʹ��ǰҪ��鹤�����Ƿ����Ҫ������Ⱦ������Ӧ��ʱ���沢������
��4��������Ӧ��ţ�����ר��ר�á�
�ڰ˽� �ྻ����������
�������ķ���Ч�������빤������������������ʽ���й�ϵ�⣬��ȡ���ڲ�����Ա�IJ�����ʽ������Լ�����ྻ���ڵIJ�����Ա�Ķ���Ӧ����������������Ҷ�����
���˲�����Ա�⣬������Ա�����ι���Ա���ϼ������Ա����ҵ�Ĺ�����Ա�ȶ����ý���ྻ����ֻ�����ڲι����Ƚ��вιۡ���鹤��������ʹ�õ�����Ӧ��������̽������ɽ��˹�������
�ྻ������Ӧ�ؽ�����Ա��������Ӧ�����ܼ��٣��ྻ����Ӧ��װ�ڲ��绰���������ӽྻ���ŵĿ��ش��������ֽྻ���ķ��������١����ͺͷ�ѹ��
��������������ԱӦ�ܸ��������Լ�������������Ա�����������ף��Ͳ����ƻ�������״̬������ʱ��Ӧ���ⲿ��������ץ�Ű��ֵķ�������Ҫ�����ֻ�ñ�ӣ���Ҫʰ���ϵĶ�������ʼ����ǰ������δ�����Ķ������Ҫ����������ϴ�����⣬ÿ����Ϣ���������ƻ�����ʱҪ�������ס�
ÿ����Ϣʱ����һ��ʱ���Ҫ����һ�ο��֡�
�����IJ�����ԱӦ���������ϲ����Ĵ�������ȷ�б�Ҫ�ϲ���ʱ��Ӧ��ȥ��������Ь�������������Ӧ����ϴ�֡�������Ȼ����ȷ��������������Ҫ���¿��ֺ������ס�
������ ��֤
��
����
��֤ϵָ������֤ʵ�κγ����������̡��豸�����ϡ����ϵͳȷ�ܵ���Ԥ�ڽ�������ļ�֤����һϵ�л����
��֤һ��������20����70�������ҩҵ���ֲ���һЩ��������GMP֮�У�������֤�ѳ�ΪGMP��һ������ȱ�ٵIJ��֡��ڹ��⼰��ҩҵ���ѵõ��㷺��Ӧ�ã�������֤�ȷ�չ�����Զ���ͨ������֤�IJ�Ʒ������������ղ�Ʒ�����ԣ�ֻ����Ϲ涨�������������Ʒ���ɷ��С������ҹ���ҩ��ҵ�У���֤�������˻���һ�����µĸ����֤�����ںܶ�������ҵ���ո������ý��٣���һ��ʮ�ֱ����Ļ��ڡ�������֤����һ�����룬��Ҫ���GMP������ҵ����������
�������Ƕ���ҩ������������֤�ֶε���ʶ������������룬ʹ��ҩGMP���š��α����ķ����һ�����������֤��������γɺͷ�չ���������������š��α�������չ�ı�Ҫ��������֤��������룬ʹGMP��������������㣬����������ת����������֤��Ҳ���������������������ۺ���ʽ��ʵ�������������֤����Ĺ㷺�ԣ���֤�������ظ��ԣ���֤���ݲ������뼰��֤�����IJ��Ϸ�չ����֤ʹGMP����������ϵĻ������м������ս�ԣ��������ǿ���������֤����ҩGMP�ġ���ꡱ������ҩGMP����������ƪ������֤��Ҫ������˲�����
�����Գ�������ʩ���豸Ӧ���а�װȷ�ϡ�����ȷ�ϡ�����ȷ�ϣ�ģ��������֤�Ͳ�Ʒ��֤�������DZ���У�顣
������Ʒ���������ռ��ؼ���ʩ���豸Ӧ����֤����������֤����Ӱ���Ʒ��������Ҫ���أ��繤�ա��������Ʒ�������Ҫԭ���ϡ���Ҫ�����豸����Ҫ�������ʵȷ����ı�ʱ���Լ�����һ�����ں�Ӧ��������֤��
���ü�����������֤ʵ��ƵĹ��̣�Ҳ�ǽ���Ƶ���������ʵ�Ĺ��̡���֤�Ľ�������ᵼ����Ƶ��ģ����������ı���Լ����ֹ�̵��ƶ������ơ�
��������Ӧ��ִ�и��ֱ���̵Ĺ��̣�ͬʱҲ���Կ�������֤���̵���������һ�����ڳ������½��У��κ�ƫ�Ӧ��¼�ڰ������Ժ������֤ʹ�á�
�豸���£����������ĸı䣬�����豸�����������к����ܵı仯���ܻᵼ������֤����״̬����Ư�ơ���Щ�ı����ͨ������֤�������µ�����֤״̬������֤�Ľ�����������йع�̵��ġ��껴�����ƣ�ʹ��ҵ������֤�䵽ʵ�������ָ�ˮƽ��GMP������
��һ�� ��֤�ķ��༰�����õĶ���
��֤��һ��ϸ��ӵĹ���������ķ�����Ϸ��࣬���Ҳ�ͬ����ҵ����ͬ�ĵ���������в�ͬ�ķ��������Ŀ��ֻ��һ��������Ԥ���ķ���������֤����ȷ���ﵽԤ�ڵĽ����Ŀ�ġ�
һ��������֤�ķ���
��һ�������İ��ղ�Ʒ���յ�Ҫ���Լ��豸�ı���������ĵ���֤���ص����
��֤�ķ�ʽ���Է�Ϊ�������ͣ�ǰ��֤��ͬ����֤���ع���֤������֤��
1��ǰ��֤ ǰ��֤����ʽͶ��ǰ�����������ָ�²�Ʒ���´������¹��ա����豸����ʽͶ������ʹ��ǰ��������ɲ��ﵽ�趨Ҫ�����֤����һ��ʽͨ�����ڲ�Ʒ����������Ҫ����ʷ���ϲ��㣬���Խ��лع�����֤�����������Ƽ���Ʒ��鲻����ȷ���������ջ���̵������Լ���Ʒ���������磬����Ʒ������������յ���֤����˼�������豸�����������յ�����ǰ����֤�Ȳ���ǰ��֤�������������Լ��ɿ��ԡ���
2��ͬ����֤ ͬ����֤��ָ��������ij������е�ͬʱ���е���֤����ʵ�������л�õ�������Ϊ�ļ������ݣ���֤���ù����ܴﵽԤ��Ҫ����������֤��ʽ�������ǣ�
(1)�����Ƶ�ȡ���ƻ��������������������ļ�رȽϳ�֡�
(2)�о�����֤�ļ��鷽�����������ȼ�ѡ���Եȶ��Ϻá�
(3)������֤�IJ�Ʒ���������൱�ľ��鼰���ա�
����ͬ����֤������ͬʱ���У���˸���֤��ʽ���ܴ�����Ʒ��������ķ��գ�Ӧ���á�
3���ع�����֤ �ع�����֤ϵָ����ʷ���ݵ�ͳ�Ʒ���Ϊ������ּ��֤ʵ���������Ĺ������������Ե���֤������߱�������������Ӧ�ã�
(1)������6������Ҫ������ݣ���20�����ϵ����ݸ��á�
(2)���鷽���Ѿ�����֤������Ľ����������ֵ��ʾ�����Խ���ͳ�Ʒ�����
(3)����¼������ҩGMPҪ��¼������ȷ�Ĺ������������й���ƫ��ķ���˵����
(4)�йصĹ��ձ����DZ����ģ���һֱ���ڿ���״̬����ԭ�ϱ����ྻ���ļ��𡢷���������������Ƶȡ�
(5)���ַ�ʽͨ�����ڷ�����Ʒ�Ĺ�����֤���Ի��۵�����������������й���ʷ����Ϊ���ݣ��عˡ��������տ��Ƶ�ȫ���̣�֤ʵ�������������Ч����
4������֤ ����֤ϵָ�Բ�Ʒ�Ѿ���֤������������գ��ؼ���ʩ���豸��ϵͳ������������һ�����ں���е��ظ���֤��������������������֤��
(1)�ؼ��豸����������̿��豸��Ԥ������һ�����ں�
(2)�����������ı����
(3)���Ʒ����з�����ϵͳ��ƫ�
(4)��Ӱ���Ʒ��������Ҫ���أ��繤�ա��������Ʒ�������Ҫԭ���ϡ���Ҫ�����豸����Ҫ�������ʷ����ı�ʱ��
��������ҵӦ����������Ʒ�����յ��ص��ƶ�����֤�����ڣ�һ�㲻�˳���2������ʹ���豸�����û���κα��������£�ҲҪ���ڽ�������֤�����Ʒ������豸�����������������ÿ����1������֤������������ģ���װ����ÿ������2�Ρ�
(��������֤������������η���
���¿ɷ�Ϊ�������ͣ�����װȷ��/����ȷ�Ϻ���/��Ʒ��֤��
l����װȷ��������ȷ�Ͻ� �ڴ˽�һ���������豸������ʩӦ�Ѿ�У������װȷ����֤��Ҫ��װ���������Ҫ��ģ�����ȷ��֤ʵÿ��װ���ܰ�Ԥ��Ҫ�������
(1)��װȷ�ϡ���װȷ���ǶԹ�Ӧ�����ṩ�ļ������ϵĺ˲飬�豸����Ʒ�����ļ�������Լ��豸�İ�װ��飬��ȷ�����Ƿ������ҩGMP�����̵ı�����ҵ�ض�����Ҫ���һϵ�л��
��װȷ��Ӧ������������Ĺ�����
�ټ������ϵ��ļ����鵵�����й���Ա�����˹�Ӧ���ṩ��ͼֽ���豸�嵥������֤�顢˵������ֲᣬͳһ��Ź鵵��ͬʱȷ����ȷ�Ժ�ʵ���ԡ�������Ʒ�����嵥���ʵ������⣬���嵥��Ŵ浵��
�ڰ�װ��顣��ר�˸��ݹ������̣���װͼֽ���ʵ�ʰ�װ��������ֲ�һ�µĵط�ֱ����ͼֽ������Ŀ�ĺ�ɫ��ǡ�ǩ�ֲ�ע�����ڣ�����ƫ�����ֱ�Ӽ�¼��ƫ����©���嵥�ϣ�
(2)����ȷ�ϡ�����ȷ����ָͨ��������ı���������SOP�����е�����ϵͳ���������飬����֤ʵ�豸�ڹ涨��Χ���ܷ��������У�����������ܷ�ﵽ�趨Ҫ���һϵ�л��
������ȷ�ϵĹ������迼���豸���еĸ�������Ƿ��ȶ���������ҵ����˵�����й涨�ı��Ƿ�һ�£��DZ��Ƿ�ɿ��������а�ȫ���Ƿ��б�֤�����أ�ͬʱҲӦȫ�濼�Dz��Ƶı����������Ƿ����ã���ҪʱӦ������Ӧ�IJ������ġ�Ҫ��Ӧ���ڴ˽ζ�ʹ���߽��в�����ά�ޱ�������ѵ��
��װȷ��������ȷ�ϡ���������豸��Ӧ����ʹ�õ��۹�ͬ��ɣ�
2������/��Ʒ��֤�� ���˽������������֤���㿪ʼ����ǰһ��ֻʹ��ȷ��һ�ʣ���Щ��ҵ�������������Ϊ��װȷ������ȷ�ϵĺ������������Щ��ҵ���������г�����ȡ�����ƶ���֤����ʱ�����ֹ��IJ�ͬ���ˡ�һ�㽨���밲װȷ��/����ȷ�Ϸֿ����С�
(1)����ȷ��/ģ������������ȷ�ϴ�Ϊ��֤���豸��ϵͳ�Ƿ�ﵽ��Ʊ�����ҩGMPҪ������е�ϵͳ�Լ������顣���豸���ԣ�ϵָϵͳ�������Գ����У��Կ����豸���еĿɿ��ԣ���Ҫ���в������ȶ��Ժ����н���������ԣ����ն��ԣ���ָģ��������
ģ������ʱ��Ӧ���ݲ�Ʒ���ص���ƹ�������������һ������£����õ�ԭ�Ͽ������Ʒ���棬���ÿհ�������Ƭ��ģ����������ˮ����ҩҺ������Һ��ģ��������ͨ��ģ������ȷ���豸�������������빤��Ҫ���һ���Լ������ܵ������Ժ��ȶ��ԡ�ģ������һ��Ӧ�ظ�3�Σ����ڱȽϼ����н�Ϊ�ȶ����豸Ҳ��ֱ�Ӳ��ò�Ʒ������֤��
��֤�����ݺͽ��Ӧ��ϸ��¼�浵���顣
��2��������֤/��Ʒ��֤��������֤/��Ʒ��֤�DZ�֤���������й��չ��̵������ԺͲ�Ʒ�����ȶ��ԵĹؼ��ֶΡ���ͬ���͡���ͬƷ�ֶ�����������������Ժ���Ҫ��������Ӱ������Ҳ������ͬ������Ӧ���ݾ����Ʒ�ļ��͡�����Ҫ��ȷ��������֤����Ŀ�����ÿ�ѧ���к�ʵ�ʵ���֤�������ƶ���������֤�ϸ��������֤��
������ҩGMP����֤�����Ҫ��
��ҩGMPҪ����֤�Ķ�����Ҫ��������������ʩ����֤���豸��֤�������������֤�������֤���Ƽ���������֤��ԭ��ҩ��������֤���������֤���������֤���ݽ������¸����н�����ϸ������
�ڶ�����֤�ij���
�����κ���ҵ���κ���ҩGMP�����ʩ���豸���κμ��͡��κ�Ʒ�ֵ��κ���֤�����������������ͬ�ġ�����������֤С�顢�ƶ���֤�ƻ����ƶ���֤��������֯ʵʩ��������֤���桢��֤�ļ��鵵��
һ��������֤С��
���ݲ�ͬ����֤���ֱ����ɸ��йز�����ɵ���֤С�飬��֤С������ҵ��֤�ܸ����ˣ���������֤��������ҵ�������쵼��
1�� ������ְ�� ��ҵ����һ������ְ�ܲ�����������֤����������Ҫְ���У�
1) ������֤�������ճ�������
2) �ƶ�������֤��̡�
3) ��ȼƻ����ƶ����ල��
4) ��֤������ݻ�Э����
5) ��֤������Э����
6) ��֤�ļ�������
�������ְ֤�ܲ������ܹ���Ӧһ���������е���ҩ������֤����Ҫ������ǽ���һ��ȫ�µ��ۺ����Ƽ�������һ����ļ�����Ŀ���д�����ǰ��֤����̨��Ҫ�ڶ�ʱ������ɣ���֤�����Ŀ�չ��������Ҫ��ȡһ���������ʽ������ʱ����֤�쵼С�顱�����п��ܰ�����Ƶ�λ����ѯ(����)��λ��
���ڹ��������Ϻã�����������Ʒ����ҩ����˵���ɲ��ü�ְ�����İ취Ҳ�ǿ���
���ܵġ�ͨ��������ܽ��еĴ�����֤�����ǻع�����֤���ʿ������������������е�
��֤�����Σ���Ϊ������������ʱ��һ����Ҫ�������ݡ�
2����֤�й��������ŵ�ְ��
(1)�ʾ���������ְ�����ĺ�����֤���������鷽����֤��ȡ�������顢������⡢���桢������ۼ��Թ�Ӧ�̵�ȷ�ϡ�
(2)�������ŵ�ְ�𣺲�����֤�������ƶ���ʵʩ��֤��ͬʱ��ѵ��������Ա����������йع�̣��ռ���֤���ϡ����ݻ�ǩ��֤���档
(3)���̲��ŵ�ְ���豸�����ù���ϵͳ��Ԥȷ�ϣ��ƶ��豸���ù���ϵͳ��֤�ı����ȡ�������ά������Ҫ����ѵ������Ա����װ����֤���ṩ��������
(4)�������ŵ�ְ��ȷ���²�Ʒ����֤���������������ȼ����鷽��������²�Ʒ���¹��յ���֤������
(5)���ϲ��ŵ�ְ��������֤����Ӧ����Ҫ������ϡ�
�����ƶ���֤�ƻ�
1����֤�ܼƻ� ��֤�ܼƻ���һ���ڲ������ļ������ü����ȷ������������һ�������������ɸ�����֤����֤�IJ��ԣ���ʵ����֤�ܼƻ�����������֤���̵�SOP��ͬʱҲ����������֤״̬�IJ���ϵļƻ���
һ�����õ���֤�ܼƻ����Ը��ٷ������Ա����֤С�����Ա�йع�����֤��һ��������ͼ��
�κ�һ����ҩ������ҵ������һ���ܹ�������ҩGMPҪ�����֤�ܼƻ��������ٰ�����
(1)��֤�ķ�Χ�ͽ��ޣ�����Щ��Ҫ��֤������֤����Ҫ���ݡ�
(2)��֤�ϸ�ı�������ҩGMP�����������Ҫ���Լ���ҵ��Ʒ����������Ҫ��
(3)��֯��������ְ�����а�����֤�ļ������������Ŀ��ơ�
(4)��֤���ȼƻ������а�����������֤��Ʒ�����ա�ϵͳ�����������ȵ��嵥��������һ���ƻ���֤��Ŀ������ʱ��ɸ���֤��ժҪ��
������֤���밴��֤�ܼƻ����У�����ÿ2���������ġ����²���һ���µ���֤�ܼƻ���Ҫ��Ը�����֤��Ŀ�ƶ���֤�ƻ���
2����֤�Ӽƻ� ��֤�Ӽƻ����������֤�ܼƻ����Եģ���ҵ���Ը�����֤�ܼƻ���Ҫ��Ը�����֤��Ŀ�ƶ���֤�Ӽƻ���
��֤�Ӽƻ����ٰ�����
(1)��飺��������֤��Ŀ�����ݼ���Χ��
(2)�������Դ���֤�Ĺ��ջ�ϵͳ����������
(3)Ŀ�ģ���������֤�����Ҫ�ﵽ��������֤Ҫ������ҩGMPҪ���豸�IJ��ʡ��ṹ�����ܡ���װ�����ܵ�Ӧ�ﵽ�ĸ���Ҫ��
(4)��֤�й���Ա����ְ��
(5)��֤�Ľ��ȼƻ�������֤�����ڡ�
�����ƶ���֤����
���Ϸ�����ʵʩ��֤���������ݣ���������Դ�����֤�������ƶ�ͨ�������ַ�ʽ��
һ���ⵥλ�ṩ�ݰ���������ǩ�����ַ�ʽ��Ϊ�½���Ŀ���ĸ�����Ŀ����Щ��Ŀ����
֤����ͨ������Ƶ�λ��ί����ѯ��λ�ṩ����һ�ַ�ʽ�����ɱ���ij������ݣ�������
�������ż������йز��Ż�ǩ��
��֤�����������ʣ��ɴ��·�Ϊ�����������ͣ�
1����װȷ�Ϻ�����ȷ�Ϸ��� �÷���һ��Ӧ�����������ݣ�
(1)��֤Ŀ�ġ�
(2)����֤��Ŀ����ɲ��ֵĸ�����
(3)��֤��Ŀ��Χ��
(4)Ҫ���ռ������ݣ�ʵʩ��֤��Ա��Ҫע������ǩ�֡�
(5)��֤������Ա��ְ��
(6)����˵�����й����ϵļ�顣
(7)ͼֽ���ϵļ�顣
(8)��֤��Ŀ��ɲ��ֵļ�顣
(9)����ϵͳ�ļ�顣
(10)��������������У���顣
(11)�������������ߵ�У�顣
(12)����ȷ�ϵ��������м�顣
(13)�йز�����̵ļ�顣
(14)������Ա����ѵ��顣
(15)��¼��
(16)����֤��Ŀ����������
2�����չ�����֤�Ͳ�Ʒ��֤�����÷���һ��Ӧ�����������ݣ�
(1)��֤Ŀ�ġ�
(2)������֤������
(3)��֤��Χ��
(4)ʵʩ��֤��Ա��ְ��
(5)��֤�ľ������ݡ�
(6)�йصIJο�ͼֽ�����ϡ�
(7)��Ʒ�䷽��
(8)�������̿��Ʒ�����
(9)������¼��
2�� ��֤������ʽʾ�� ����7��1��
�ġ���֤����֯ʵʩ
��֤������������֤С����֯����ְ�ܲ��Ź�ͬ����ʵʩ��
ʵʩ���̿ɰ���װȷ�ϡ�����ȷ�ϡ�����ȷ�ϡ�������֤����Ʒ��֤�Ƚν��У������ø��α������ݡ���֤С�鸺���ռ���������֤�ļ�¼�����ݺ���ݽ��Ժ����ս����ļ����ϱ���֤�ܸ�����������
�塢��֤���漰������
��֤��������֤�������ܽᡣΪ�˱����Ժ����֤�������µļ�����Ŀ�ο���Ӧ��һ����Ҫ�ļ����������ʽ��������֤�Ľ������������֤�����ս���������ۡ���֤����Ӧ�������֤ʱ��Ľ��顣������֤����ʱ��Ӧ��������֤����������������Ժ˶Ժ���飺
(1)�����Ҫ����֤�����Ƿƻ���ɡ�
(2)�����֤������ʵʩ�������з��ģ��������Ƿ���ȷ������������
(3)��Ҫ�������ļ�¼�Ƿ�������
(4)��֤����Ƿ�����趨�ı�����ƫ����Ľ���Ƿ��������飬�Ƿ����ʵ���
���Ͳ��������
��֤�����������֤�����Ļ�ǩ�˼�����˺�����


������֤�ļ�����
��ҵ�ƶ���֤�����ƶȺ���֤��̣���ѵרҵ��Ա����֤�������γɵ��ļ�Ӧ����֤Ʒ�ַ��࣬�鵵���档
��֤��������¼�����桢֤��ȶ����뱣������ϵͳ���豸ʹ���ں�6����
������ ��������ʩ����֤
��������ʩ�漰�����ֽ��������ˮ���յ�����ϵͳ(HVAC)����ȫ�����ȹ��ù��̡��°���ҩGMP��¼��Ҫ����ҩ����������Ӧ�Կ�������ϵͳ��������ˮϵͳ����������ϵͳ������֤��
��������ʩ����ҩGMPҪ�����ڵ����³�������ʩ�������꾡������������ֻ��Ҫ�г�����֤��Ҫ�㡣����λ������ݸ������Ҫ������ȷ�ϡ�
һ����������ϵͳ��֤����Ҫ����
1��HVACϵͳ����������У�� ��HVACϵͳ�IJ��ԡ���������ع�������Ҫ�Կ�����״̬����������ý�������������յ��豸�����ܲ���������Ľྻ�Ƚ��д����IJⶨ����������õ�������������ݽ��бȽϡ��жϡ���Щ���������IJⶨ��Ҫʹ�þ����춨����ȷ���������DZ�����ɡ�
�����DZ��춨��У�����궨��Ӧ��ϵͳ���Ժͻ������ǰ��ɲ���¼�ڰ���Ϊ������֤�ļ���һ����ɲ��֡�
2��HVACϵͳ��װȷ�� HVACϵͳ��װȷ����Ҫ�ɹ��̲���(�������豸��������������������)�����������У����������豸(��Ҫ�ǿյ��ͳ�ʪ��)�İ�װȷ�ϣ������������װ��ȷ�ϣ���ܼ��յ��豸��ϴ��ȷ�ϣ��յ��豸���õ��DZ�������������һ�������춨���棻HVACϵͳ�����ֲᡢSOP�����Ʊ�����Ч�������ļ�©���顣
3��HVACϵͳ������ȷ�� HVACϵͳ������ȷ���ɹ��̲��Ÿ�����ҪΪ��鲢�Ͽ�ʩ���Ӷ��������ݵ������ԵĽ�����յ��豸�IJ��ԣ���Ч�������ķ��ټ���������ⶨ���յ����ԺͿ���ƽ�⣻�������Ӻ������Ԥ�ⶨ��
4���������������������� HVACϵͳ���½����Ľ��Ժ����ȫ����֤(����ȷ��)���������к�ֻ���¼������¡�ʪ�ȣ���鷿��ķ�ѹ���ɡ��յ�ϵͳ�п���ƽ�⡪��������ƽʱ�������䶯�緧λ�ã�һ��ֻ��ÿ����һ�η������Ӷ������������������������ɡ�����Ʒ�������Ի���Ҫ����ϣ���HVACϵͳ��װ��������֤�⣬��Ҫ���ڲ��ԡ�Щ��Ŀ���磺
(1)��Ч������ÿ������1��й©���顣
(2)��Ч����������������������й©���顣
(3)HVACϵͳ�ķ���������1�Σ������㷿��Ļ���������
(4)�ྻ��10 000�����ϵķ���������Ʒ�����ڼ䣬Ӧÿ�����ѹ��ʹ����ʼ�ձ�����ѹ״̬������ÿ3�����һ������⡣
(5)������Ⱦ������ϸ�����ԣ�������Ʒ�����ڼ�Ӧÿ����С�
(6)����Ʒֹͣ������HVAC�رպ�Ҫ�ָ��������谴��֤Ҫ��������������������ξ���������IJ��ԡ�
����������ˮϵͳ����֤
����ҩGMP���Թ�����ˮ�Ľ���Ϊ����ҩ����������ʹ�õ�ˮ������������ˮ������ˮ��ע����ˮ����
����������ˮϵͳ��Ҫָ����ˮ��ע����ˮ(�����������)ϵͳo
1��ˮϵͳ�İ�װȷ�� ˮϵͳ�İ�װȷ�Ϲ����ɹ��̡��豸������ɡ���Ҫ�Ǹ�������Ҫ���ˮ�����豸�ܵ�ϵͳ�İ�װ�Ƿ�������Ҫ���ܷ�������Ҫ����Ҫ�����У���ˮװ�õİ�װȷ�ϣ��ܵ�����ϵͳ�İ�װȷ�ϣ������DZ���У�����г�ˮϵͳ�����豸�����ֲ���ճ�������ά�ޣ�����SOP�ȡ�
2��ˮϵͳ������ȷ�� ˮϵͳ����ȷ�ϵ���Ҫ�����У����ˮ���������豸������������ⶨ�豸�IJ�������鷧�źͿ���װ���Ƿ������������ˮ�ļ��ȱ�������ȡ�
3��ˮϵͳ�ļ�ؼ���֤������
(1)ϵͳ���ɻ�Ľ����������֤��
(2)������ƺ�ʹ�����Ӧ�г���3�����ڸ�ȡ����ÿ��ȡ������ļ�¼�����в��ϸ�㣬��������ȡ�����ز�������ϸ�
(3)ˮϵͳ������һ��ѭ��ˮ�ò���ֹͣ��������ͣ�ã�����ʽ����3������ǰ����ˮ����ϵͳ����3�����ڵļ�ء�
(4)ˮϵͳ�Ĺܵ�һ��ÿ���������������1����
������������ϵͳ����֤
��������һ��ֱָ�ӽӴ���Ʒ�ĵ����壬����Ϊ�����������õĵ�����������̼��ѹ�������ȡ�Ӧ�����¼������������֤��
(1)���幩Ӧ(һ���Ĵ��Ⱥ�����)������Ҫ�����ڴ��ȣ�����ʹ��������С��ϵͳ�Ĺ�Ӧ����
(2)������ʩ�Ĺ�ģ������ʶ������ɺ��ʵIJ����Ƴɵģ�����������Ӧ��
(3)����ϵͳ�Ĺ�ģ��С������ʣ����ṩ��Ҫ���������������Ϻ��ʣ�����ϵͳ������������Ͳ�����Ӱ�Ρ��������������ϵͳ�������������Ⱦ����������κ�ϵͳ������
�ġ��������ù��̵���֤
�ڳ�����ʩ����֤�г�ǰ�������⣬����һЩ���ù��������ˮϵͳ������ϵͳ����¯�������Դ�����������ϵͳ������ϵͳ�ȣ�Ҳ��Ҫ�������йر����淶���йع涨�������պ���֤��
�塢������ʩ��֤�ļ�������
��֤�����е����ݺͷ������ݾ����ļ���ʽ���沢�鵵��������Ӧ������
(1)��֤��Ŀ�����ڡ�
(2)��֤Ŀ�ġ����������漰���ˡ�
(3)��������ʩ��װ�������档
(4)���ۺͽ��飬��������֤��ʱ�佨�顣
(5)֤�顣
���Ľ� �豸��֤
�豸��֤��������֤������ĵ�Ԫ���豸�İ�װȷ�ϡ�����ȷ�ϼ�����ȷ����һ����֤�Ļ�������Щ��λ�������ȷ�����뵽�豸��֤�ĵ�һ���������豸�������ѡ�ͽ���ȷ�ϣ��Թ�Ӧ�̵�ѡ��ŵ����豸��Ԥȷ���С�
�豸��֤���°������������֡�
һ����װȷ��
1��ȷ�ϵ�����
(1)��鼰�Ǽ��豸�ij������ƣ��豸���ơ��ͺš��������̱�ż��������ڣ���˾�ڲ��豸�ǼǺţ�
(2)��װ�ص㼰��װ״����
(3)�豸�����Ƿ�������Ҫ��
(4)�������DZ��Ļ�ȷ�Ժ;�ȷ�ȣ�
(5)�豸��Ӧ�Ĺ��ù��̺ͽ�����ʩ�����ף�
(6)��������������������㣻
(7)�ƶ���ϴ��̼���¼��ʽ��
(8)�ƶ�У����ά�����������е�SOP�ݰ�����¼����ʽ�ݰ���

��������ȷ��
1��ȷ�ϵ�����
(1)��SOP�ݰ����豸�ĵ�����ϵͳ���п����Գ���
(2)�����豸���в����IJ�������
(3)���DZ���ȷ��ǰ�������һ��У�顣
(4)�豸���е��ȶ��ԡ�
(5)SOP�ݰ��������ԡ�
(6)�Բ�����Ա����ѵ��顣
2�� ��ȷ�ϱ���ʾ�� ����7��5��
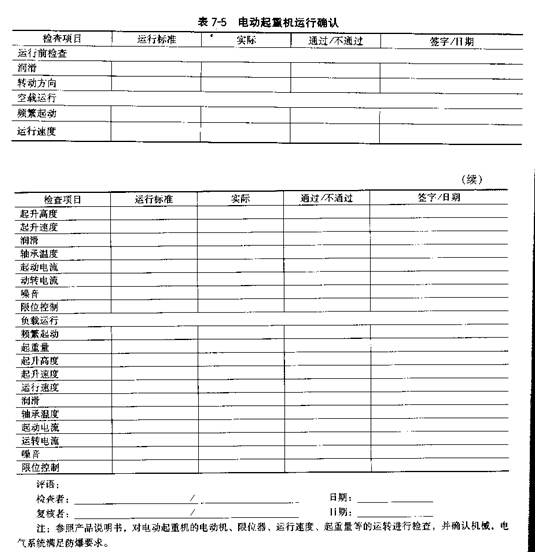
��������ȷ��
ȷ�����ݣ�
(1)�հ��ϻ����Ʒģ��������
(2)��Ʒʵ����������
(3)��һ���۲�����ȷ���в������ȶ��ԣ�
(4)��Ʒ����������
����� �������������֤
����ҩ������������֤��ϵ�У���������ռ���൱��ķݶ������ҩ���Ľ�������ѭ������״̬�ļ�ء���ҩ����ҵ��������������������֤Ҳ�����⣬��ˣ�������鷽���ͼ��������Ƿ����ʹ��Ҫ��Ҳ��Ҫ��֤��ȷ�ϣ���������֤������������֤��ʼ֮ǰ������ɣ���Ϊ����������֤����Ҫ���ߺ��ֶΡ�
һ����֤���ص�
�������������ص�Խྻ�ҡ�����ʩ���������Է�����ȡ����������ԭ���ԡ������顢�춨������Ʒ���ζ�Һ��ʵ�鶯�P�����Ƚ�����Ч����֤���������¼����������֤�Ļ�����⼰���鷽������֤��Ϊ��Ҫ��
������֤������
1������������ȷ�� ���������ȷ���Ǽ��鷽���ͼ��鷽����֤�Ļ��������Ӧ��Ͷ����ʽʹ��֮ǰ����ȷ�ϣ�����������֤��ʼ֮ǰ��ɡ��������ȷ�Ϲ�������Ӧ�����������͡��������ܶ�����ͨ����������װȷ�ϡ�У����������Ԥ�������ȷ�ϡ�
(1)��װȷ�ϡ�
�ٵǼ��������ơ��ͺš������������ơ��������ڡ���װ�ص�ȡ�
���ռ����ͷ�������ʹ��˵�����ά�ޱ����ֲᡣ
�ۼ���¼�����յ������Ƿ���ϳ����涨�Ĺ�����
�ܼ�鲢ȷ���и�������ʹ��˵���顢ά�ޱ����ֲ�ͱ����嵥��
�ݼ�鰲װ�Ƿ�ǡ���������缰��·�����Ƿ����Ҫ��
���ƶ�ʹ�ù�̺�ά�ޱ����ƶȣ�����ʹ���ռǺ�ά��¼��
���ƶ���ϴ��̡�
����ȷ�����豸�������ϵ�ר����Ա����ŵص�ȡ�
(2)У������ÿ�������IJ�ͬҪ�����У����������ֹ��ȼ�У�������������������ն�ȷ�Բ��ԡ���ɢ����ȣ�����ɫ�������ЧҺ��ɫ���Ǿ�Ҫ����ϵͳ�����飬�ڹ涨��ɫ�������²ⶨɫ��������С����������������Ⱥ���β���ӣ����涨����ϵ���ȡ�
(3)������Ԥ���顣������װȷ����ɺ����书���������Ҫ�������£����ñ�Ʒ�����Ʒ������������Լ�飬��ȷ�������Ƿ����ʹ��Ҫ��
��������������鹤����ͬʱ��Ӧ������Ӧ���ļ���¼�����Ϲ鵵������ÿһ̨������Ӧ��һ�������ĵ������ϡ�
(4)��ȷ�ϡ�Ϊ��ȷ�������������õ�ʹ��״̬������ÿһ̨�¹����������ȷ�Ϲ���������Ӧ�������������ȷ�ϵľ����ƶ���ȷ�ϵļƻ�����ȷ�ϵ�ʱ����������Ҫ������������ʹ�����������һ����3���¡�6���»�1�ꡣ��ȷ�ϵ�����ͨ����������·���ӡ�������Ʒ���ļ�顢�������������顢�����ռǵȣ������ص��ǰ�װȷ���еĹ������顣
2�����鷽������������֤
(1)ȷ�����顣����ֵ����ֵ���ӽ�������ֵ�������С������ֵ����ȷ��һ����ö������顢��������Ϳհ�����������ȷ�ȡ��ڼ��鷽����֤�У�������ȷ��ͨ���û���������ʾ��
(2)���ܶȲⶨ�����ܶ���ָ��ͬһʵ�������£���ͬһ������ijһ�ɷֽ��ж�βⶨ������õ�ֵ�˴˷��ϵij̶ȣ�Ҳ�������ԡ����ֵ�˴����ӽ���������ƫ����С�������������ܡ����ܳ�����Ա�������ʾ����Ʊ���ϵ����
(3)���Է�Χ���顣ȡ��������ƷŨ����һ����Χ�ڱ仯ʱ���ⶨ�����Ľ��Ҳ�����ȵı仯��������ȡ����Χ��֮Ϊ���Է�Χ�����ʵ�������Χ��ȡ�������ܴﵽȷ�Ⱥ;��ܶȵ�Ҫ�����Ӧ�������Է�Χ���顣
(4)ѡ�������顣ѡ��������Ӧ���ݱ�����Ʒ����ҩ���м������ܵķֽ�����Լ����õĸ��϶���֤���鷽����Ӱ��������飬��ѡ�������С�����ŵļ��鷽����
�����ϼ��鷽����֤�������������У�����Ҫ����ȷ�Ⱥ;��ܶȡ�Ϊ��˳�������֤���飬�������ر�ע�⣬ȡ��Ҫ�д����ԣ�����Ҫȷ������������հ�����Ӧͬʱ���У��Լ���ҩ�Ĵ���һ��Ҫ�껯��
����������������
����������Ҫ�к������������࣬Ӧ���������������йع涨����У����
1������������У�� ���õ���У���IJ��������еζ��ܡ���Һ�ܺ�����ƿ���֡������������ݻ�����һ����������ʾ���ݻ�һ�£�������������Ӧ�õ�������������Ҫ��ȷ���ݻ��������Ӱ����������ȷ�ԡ�
2������������У�� ���������м���������Ҫ�Ƿ�����ƽ�����õķ�����ƽ�е����ƽ�͵�����ƽ��
�ġ������������֤�ļ�
�����������֤�ļ������ݿɲ��ճ�������ʩ��֤�ļ������ݡ�
������ �����֤
�����֤��ָ���豸����������������Ч�Ե���֤����Ŀ����֤�������õ�����ȷ�ܱ����Ʒ�Ľ�����Ⱦ�Լ���ϴ����������Ⱦ��
��֤�����ݰ�����ϴ���������������Ƿ�����ȥ������ϴҺ����������������ⶨ�������ȵȣ���֤ʱ���ǵ�������Ϊ�豸������ϴ�IJ�����������ϴ�IJ�Ʒ�Լ���ҩ�Ļ��Եȡ�
1���������� ����ijһ�ص���豸���������趨����ϴ����(����ѡ��������)����Ҫͨ�����ַ�������֤���豸������ijһƷ�ֺ����ϴ�Ƿ������ҩGMPҪ��
(1)Ŀ�ⷨ����Ҫ�����ϴ����豸�������ڱ����Ƿ��пɼ���������������ζ��
(2)���ճ�ϴҺȡ���������ռ��ʵ������һ����ϴҺ��Ϊ�������������Ũ�ȡ�
(3)��ǩ����ȡ����������պ���ʵ��ܼ�����ǩ���豸�������Ĺ涨��С�ڱ����ϲ���ȡ����Ȼ�����ʵ����ܼ�����ǩ�ϵ���Ʒ�ܳ������ԡ�
���ճ�ϴҺȡ��������ǩ����ȡ��������Ʒ���ڲ�����ȡ��������Ӱ�������£�ҩ�������һ����Ϊ0.001������ߡ�����Ҫ�����ڲ�Ʒ�Ӵ��ı�����ȷ�����������Ӱ��������Ʒ����һƷ�ֵ���������Ŀ�ⷨһ������ڲ�Ʒ��ֱ�ӽӴ�������档
2��ѡ���ⷽ��ʱ��ע������
(1)�뱻������ʼ��������������ض�������ԣ��Ա�֤��ѡ���ļ�ⷽ������ȷ��ӳ���������ʵIJд�����
(2)���㹻�����ȣ���������Ӧ����ǰ��������������Ӧ��
(3)��ⷽ���Ǽ��ģ�һ������ҵ�߱���ɼ�����������һ�����ⷽ�������У������֤����������3�����Ľ������Ҫ���Զ���ϴ��������ÿ3�����һ������֤��
���߽� �Ƽ���������֤
�Ƽ���������֤��������֤��Ʒ��֤��ϸ�����в��������뱾��ǰ��������ͬ�����ƣ��й���һ�������ݱ��ڲ����ظ�������Ӧ����Щ���Ƶ��Ƽ���������֤����Ҳ�Ǵ�ͬС�죬����ҵӦ����������Ʒ���ص㣬������������һ�¸�������������Ҫ�㼰��������Ҫ���Ҫ���������֤�������ƶ�������֤������ʵʩ��֤������
�Ƽ�������֤Ӧ���������������������豸���������Ʒ�������Ʒ�������չ��̵ȵ���֤��
1���������� ���ݲ�ƷҪ��Ľྻ���𣬲��յ����¼����µ�������������ⶨ���Խྻ����ʹ�û���ʹ�õ���������ҲӦ��֤��
2. �����豸 ���ݲ�Ʒ����Ҫ����豸�����µ��Ľڵij�����а�װȷ�ϡ�����ȷ�ϡ�Ҳ��ѡ������ȷ�ϼ�����ȷ�Ͻ�ϲ�Ʒ���ս���ȷ�ϣ�����Ʒ����Ҫ���ƶ��������Ŀ������������������
3���������Ʒ��� ��Ҫָ���ݲ�Ʒ����Ҫ��ȷ���������������б��ȡ�
4����Ʒ�������չ��� ���ܶԲ�Ʒ�������������Ӱ��Ĺؼ��������ն�Ӧ������֤����֤�Ĺ�������Ҫģ������ʵ�ʲ����ǿ������������������Բ������״��������(�������)����ս�����顣��֤��IJ�Ʒ�����Ծ�����֤�ļ��鷽������������һ��Ӧ��֤�����ظ������������ϣ���֤�����յĿɿ��Ժ������ԣ�
���������ϵָ�ù���������״̬���䵼�¹��ռ���Ʒʧ�ܵĿ����Ա������Ĺ�����������
��ս�����飺ָ��ijһ���գ��豸����ʩ�趨�Ŀ������������飬�����������ϸ�����ڶ���ָʾ���Լ������˵ij�������ȡ�
�����һЩ���ջ���̵���֤�ںܶ�����ж���Ӧ�ã����磺ϴƿϵͳ�����ϵͳ�����˳���ϵͳ�ȡ�
(1)ϴƿϵͳ��֤��
��ϴƿˮ��Ӧ�������ȼ��(�����)��
��ѹ��������Ӧ��鳾���������͵ȡ�
��ϴƿ��������������ʽ����:Ӧ���豸��֤Ҫ����а�װȷ�ϡ�����ȷ�ϡ�����ȷ�ϵ���֤��Ӧ����Ҫ��
�ܰ�곡�����ƿ���ȹ�װע����ˮ��ҡ��ˮ����Ȼ����г����ȡ����������������ȡ�
(2)���˳���ϵͳ��֤
���˳���ϵͳ����֤������Ҫ������
1) ����ϵͳ�Ա�������Һ����Ӧ�ԡ�
2) ���˲��϶���Һ����Ⱦ�̶ȡ�
3) ��������ϵͳ�Ĺ��
4) �������������
5) ����ϵͳ�����������顣
6) ��������
7) ������ҩҺ�ĺ��������Ƽ�����ʱ������
8) ��������ʹ�������ȡ�
(3)���ϵͳ����֤
�ٸ������������ԭϵͳ����֤��
a�������������װ����ȷ�ϡ�
b������������豸������ȷ�ϡ�
c���DZ�����
d������ȷ��(���������֤)������֤�������������ǰ�������У���������ȷֲ����顢�����ȷֲ����ȴ����顢�����м���������ڳ������Ӽ�����������������ϸ���ڶ��������֤�ȡ�
��ʪ�����ϵͳ����֤�������DZ�У������ն����顢���״̬�����ǻ����й©���顢�ȷֲ����顢�ȴ�����������顣
�۷�������Ĺ�����֤�����������Ҫ�����ڶ������е���Ʒ�Ͳ�Ʒ�����������֤���̳�������ϵͳ����ͬ��Ҫ���⣬һ�㻹Ӧ������
a��ȷ��ÿ����װ�д������Ʒ�ľ�һ�ԡ�
b��ȷ���������Ʒ�ڷ�����������е�װ��λ�á�
c��ȷ�����ǻ���ڷ�������ֲ�ͼ��
d��ȷ������ʱ����֤��������������㹻������������������
e���þ���У���ġ�����������ⶨָʾ����ȷ�ϲ�ͬ��Ʒ������Ƶ�װ��ٻ�������ա�����������������С������������ֲ���
���������������ϵͳ����֤Ӧע���¶ȡ�ʪ�ȡ�����Ũ�ȡ���¶�������ʱ������ص����Լ���ء�
�����ѡ�ĸ��д����Ե��Ƽ�������֤�������ۣ�����������������֤�ɲο����С�
һ�������������֤
1�����ϵͳ����֤ ���������� ��
2�����ù���ϵͳ������ ͬ��������ʩ����֤��
3������װģ��ʵ�� �����з�������ģ���װ����������ģ������װ�������֡�
4����Ʒ�������չ��̵���֤
(1)��ò�Ʒ��ص��������չ�̡�
(2)�ò�Ʒ����������ʹ�õĹؼ��豸������ϵͳ�������ԡ�
(3)�ò�Ʒ��������������ྻ����ʪ�ȡ��¶ȼ�������ҩGMPҪ�������������
(4)�ò�Ʒ��������ʹ�õ�ԭ�����ϣ����а���ע����ˮ�����������ϸ�Ĺ�Ӧ�̡�
(5)�ò�Ʒ�����ø���ԭ�����ϣ���ƿ�������ǵ���ϴ��������̵���Ч�Լ���ԭ��ҩ��ת�Ʒ����Ŀ����ԡ�
(6)������Ա�����¡�������������������ѵ���������ۡ�
(7)��Ʒ��װ���������еIJ�Ʒ�������Ƽ��������̵��ȶ��ԣ���װ������Ŀ��ƺ������������Լ�صȡ�
(8)���ղ�Ʒ�������ۣ����г����Ʒ�����е��������⣬Ӧ���۲�Ʒ�����ԡ������ԡ�����������Ʒ�ľ�һ�ԡ�
����С����ע���������֤
1�������빫��ϵͳ��֤ ͬ���µ����ڳ�������ʩ��֤��
2���豸��֤ С����ע����������豸��Ҫ��ϴƿϵͳ������ϵͳ������豸�������ȡ�����С����ע��������Ĺ���������Ҫ���˰����ʹ��۲�����������Ĥ�������ȡ�Ӧ�������ദ����������ٲⶨ�����ⶨ�ȣ�Ӧ��������Ҫ��
(1)����豸���μ����ϵͳ����֤���ݣ�������ѹ���������ͨ������������֡�
(2)���ϵͳ����֤������Ҫ�У�
�ٹ��������ҩҺ��ע��(����ҩҺ���ȣ����ʵ�������װ��������ע�ٶȡ���ڵ�����ԡ�
�ڶ������壺��鴿�ȣ�Ӧ��99�����ϡ�
�۰�곿ռ��������壺����������Ӧ�ﵽ���Ҫ��
3������������֤ С����ע����������̰���ԭ���ϵ�������Һ�����ˡ�������ڡ�������©��������顢ӡ�ְ�װ�Ȳ��裬ÿ�����趼Ӧ������֤��
С����ע����������յ���֤�У�ͬ�������ȶԼ��鷽��������֤(�����µ���ڼ������������֤)��Ȼ���������չ�̽�������������Ʒ��֤��
����������֤�а��Ʒ�ļ�����ݰ���������ǰ��ҩҺ����������װǰ��ҩҺ�������������ȡ�PH�����Գɷֺ�����װ������ȣ���Ӧ���Ϲ涨���Գ�ƷӦ������鼰�ȶ��Կ��飬ÿһƷ��ÿ�ֹ��IJ�Ʒ�IJ�Ʒ��֤����Ӧ��3����֤���ݡ�
С����ע�������������֤����ָ����Ҫ�У�
(1)������ǰҩҺ������(�������������������IJ�Ʒ)Ӧ��10��/ml��
(2)ϸ���ڶ���(����Һ���Ӽ�����)��Ӧ��0��5EU��ml��
(3)���ǰҩҺ�Ĵ�������Ӧ��100����ml��
(4)�����ȣ�Ӧ�����
(5)pH��Ӧ�����ڿ�������Ҫ��
(6)���Գɷ֣�Ӧ�����ڿ�������Ҫ��
(7)�ܵ����Һ��������Ӧ����Ҫ��
(8)����װ����Ⱦ�ʣ�0��1����
����Ƭ��������֤
1���豸����֤ Ƭ����������Ҫ�豸�����ϻ��������������������������۴������ɸ������ϻ���ѹƬ�������¹�����װ���ȡ���ǰ���豸��֤һ��Ӧ�Ը��ֻ����ڷֱ���а�װȷ�ϡ�����ȷ�ϼ�������ȷ�ϵ���֤�����������DZ�ҲҪּ�Ƚ���У�����йص�������֤���ԣ��������������������֤��
2��������֤
(1)���顣��������������ٶȡ�ɸĿ��С���ͺš����ķ���ÿ��ȡ3��5����Ʒ��������ɸĿ���������ܶȡ�����ʱ�䡢��ֹ�ǡ�������������̹涨�������飬����Ӧ����Ҫ��
(2)Ԥ��ϡ�����������������ת�١����ʱ�䣬ÿ��ȡ3��5����Ʒ��������ˮ�֡�������������������̹涨������ϣ�����Ӧ����Ҫ��
(3)�����������������������������ʱ�䡢�����¶ȼ�ʱ�䡢�ϼ�Ũ�ȼ�������ÿ��ȡ3��5����Ʒ��ƺ����ˮ�֡�ɸĿ���������ܶȡ�������������̹涨��������������GMP����Ҫ��
(4)�ܻ�ϡ����������������ij��Ʒ�涨���ʱ��10���ӣ���֤ʱ���Ϊ5��10��20���ӣ�ÿ�����費ͬȡ���㡣�������������ȶȡ�ˮ�֡����ȷֲ������ɶȡ���ɫ���ȶ�(ָ�в�ͬ��ɫ���ֵIJ�Ʒ)����֤10���ӵĹ涨�Ǻ����ġ�
(5)ѹƬ���������������ת�١�ѹ����ѹƬʱ�䡣�趨ÿ15����ȡ��1��ֱ��300���ӡ���������ۡ�Ƭ�ز����ȡ�Ӳ�ȡ��ܳ���(����ʱ��)������������ȡ�
�ġ�Ԥ���������֤
��������ʩ���豸����������鷽���������֤���ϸ�����֤Ҫ�����⣬Ԥ�������������֤��ҪΪ���鷽����ϸ�ȡ������¶ȡ�����ʱ�䡢��ϻ�װ����ת�١����ʱ�䡢��װ����֤�Լ���Ʒ��һ�Ե���֤��
�����о�ij��һ��Ԥ�����Ʒ���ʱ����֤����װ��֤����Ҳο���
1�����ʱ����֤ �����֤��Ŀ���ǶԻ�Ϻ�Ĵ���װƷ�ڻ�Ϲ��ڵķֲ�������м�顣����ѡȡһ��������ȡ���㣬ȡ���㾡���ֲܷ����ȣ��迼�����ѻ�ϵIJ�λ��Ȼ���趨��ͬ�Ļ��ʱ����5��10��15���ӡ������Ը���ʱ������ȡ���������������ѡС��ѻ��ʱ�䣬�Դ���Ϊ�ڶ����������λ��ʱ������֤���ϵľ�һ�ԡ�
�����
��Ʒ����Ч�ɷֺ��������㺬����Ӧ�ڱ�ʾ����90��~110��֮��
ƽ��������Ӧ�ڱ�ʾ����95��~105��֮��
��Ա�ƫ�Ӧ������6��
2����װ��֤ ��װ��֤��Ŀ����֤����Ʒ�ľ�һ�Լ���װ������Ҫ���ֱ��ڹ�װ�IJ�ͬʱ��������ȡ��Ʒ��һ���Ƽ��ӽ�Ҫ���۵ĵ�һ����������в������м���ȵز���8������10�㡣�ֱ���ؼ�ȡ���ͼ졣
���������б껴��ͬ�����֤����װ��Ӧ������ҩ��Ҫ��
�塢�Ƽ��������ּ��Ͳ�Ʒ��������֤ʱ����м�����Ŀ
1��Һ����������
(1)�м���ľ�һ�ԡ�
(2)���ʱ�䡣
(3)��װ������
(4)��Ʒ���ơ�
2�������Էۼ���ɢ��
(1)��ϵľ�һ�ԡ�
(2)��װ�ľ�һ�ԡ�
(3)װ�����졣
(4)��Ʒ����
������������δ�ἰ�Ŀɲ������ϸ�������֤���������������ռ���������Ҫ�������֤��
�ڰ˽� �����ϵͳ��֤
�����ϵͳ��֤���Խ���������֤�ĸ��������⡣������֤�еġ����ա�����ڼ�����ġ����롱���̺͡��ڲ�����������(����)���������õ����豸�൱�ڼ������������Χ�豸(Ӳ��)�Լ�������ص������豸�����������豸������������֤�ġ���Ʒ���൱�ڼ�����ġ�����������һ�豸�Ŀ��Ƶȡ�
����ҩGMP��صļ����ϵͳ��Ϊ��Ҫ��֤�ļ����ϵͳ�� �������ڿ����������̣��������Ʒ���졢�������ơ�������֤��������ݵļ����ϵͳ��Ӧ��֤��
����ʮ������֤Ҫ��Ҳο�
1�������ϵͳ��֤�ƻ� �������֤�ƻ���Ҫ�����ƻ�����֤���������ְ���Լ�������
2�������ϵͳ�ļ� ��Щ�ļ�����Ӧ�и�ϵͳ�������������ʹ�ø�ϵͳ������صļ������ϡ�
3�����Ӽ�¼��ǩ�� ������Щ�е���ǩ���͵��Ӽ�¼��ϵͳ������������ļ���������֤����Щ���ӵ�ǩ�����¼�ǵõ���Ȩ�Ϳ������ġ�
4����Ӧ�̵��������� �����һ�ݹ��ڹ�Ӧ�̱��������(�����)�ı��棬�Ա�Ը���֤�������ȷ���ۡ�
5������ ���Եı����ļ�Ӧ����ʾ�����ƽ̨��Ӧ����������ȷ��װ�Ͳ��ԣ����Ҳ��Խ����Ԥ�ڡ��£��������������ظ��ԡ�
6����ѵ ������ѵ��¼��ʾ��֤С���Ա���ṩ֧�ֵ���Ա��������Ա�Ǿ�����ѵ�����ʸ������ϵͳ�ġ�
7����ȫ ������ӦSOP��ȫ�ƶ������ƽ����ϵͳ��
8���ɳ����Լƻ� ������һ����α��ݺͻָ�ϵͳ�ļƻ����Է���һϵͳ̱�����ܾ���ָ����С�
9��������� ������������ļ�������ϵͳ���κα�����Ա�֤��ϵͳʼ�ձ�������֤����״̬��
l0�����Լ�� ϵͳһ��Ͷ��ʹ�ã����붨�ڶ�ϵͳ���м�鲢д�����汨�棬�Ա�����Ƿ��ϵͳ��������֤��
11����֤�ļ����� ������֤�ļ�Ӧ����浵����ʱ�ܹ�֧�ֺ�ά��ϵͳ�����л���֤��
12�������ϵͳ��֤���� �ñ�����Ӧ������֤��ļ�¼���κ���������֤�ƻ���֮ͬ�������Ƿ�ͨ����֤����Ͷ��ʹ�õĽ��ۡ�
�ڰ��� �ļ�
��
�� ��
��ҩ������ȫ�������ն������ļ���¼�ķ�ʽ��ӳ�ģ����ļ�������ҩ�����ĵ�λ�������ء�������WHO��GMP����ŷ�����GMP�Լ��ҹ�����ҩGMP���������ļ���������Ϊһ�£��ɼ��������ӳ̶ȡ�ŷ�����GMP�����ļ���һ���е�һ�仰����ָ�����ļ������ĵ�λ��Ŀ�ģ������õ��ļ�����ϵͳ��������֤��ϵ����Ҫ��ɲ��֡�������ļ��ܷ�ֹ����ͷ������������IJ����ʹ������ʷ���п����ԡ���Ҫ�ﵽ������Ŀ�ģ����뽨�����õ��ļ�ϵͳ�Ĺ�����̡�
��ҩ������ҵʵʩ��ҩGMP��һ����Ҫ���⣬����Ҫ���������������������ļ����֣����������Ż�����ҩ������ҵ��������ҩGMP�������ʱ�����걨���ϱ���������������������ļ�Ŀ¼��Ŀǰ�ҹ���ҩ������ҵ��ʵʩ��ҩGMP�д�������Ľ϶�ľ�����ҩ�������������������ļ��ı��Ʋ����淶���걸����ν���һ���걸���ļ�ϵͳ��ȷʵ�ǰ���ÿ������ҩ������ҵ��ǰ��һ����Ҫ���⡣
��һ�� �ļ����ļ�ϵͳ���ļ������ĸ�����ļ�����������
������Ҫ�����ļ����ļ�ϵͳ���ļ������ĸ����ȷ�ƶ���ҩGMP�ļ������塣
һ���ļ����ļ�ϵͳ���ļ������ĸ���
�ļ�����ҩGMP����Ҫ��ɲ��ݡ��ҹ��°䲼�ġ���ҩ�������������淶����2002���)�ڰ����ļ��й���������Ŀ���ֱ�涨������ҩ������ҵӦ���������������¡����������ĸ����ƶȡ���¼�����������ƶȼ���¼���ٰ�����ҵ������7���ƶ���������Ʒ���������ļ���������Ʒ���������ļ��������ƶ��ļ��ij����������ƶ��������������������ļ���Ҫ������
�ļ�һ����ָ�ɷ������ء���λӡ���ģ����������������������ض���ʽ���������ֲ��ϡ������ļ������÷�Χ���ɷ�Ϊͨ���ļ���ר���ļ�����ҩ������ҵ���ļ���ָһ���漰��ҩ���������������������������ʵʩ�еļ�¼����� WHOҩƷ�������������淶(1992��)���ļ��Ķ����ǣ��ļ���������֤��ϵ�Ļ������֣����漰GMP�����з��档��Ŀ������ȷ���������ϵĹ����������ͼ��鷽������֤�������йص�������Ա֪����ʲô����ʱ������֤��Ȩ�˾����㹻�����Ͼ�������ҩƷ�Ƿţ��ṩ�ɶԻ�����ȱ�ݲ�Ʒ����ʷ���е�����������ļ�����֭��ʹ��ȡ���������ߡ�Ӣ��GMP���ļ��Ľ����ǣ������漰ҽҩ��Ʒ�������������������ָʾ˵���ͼ�¼���������Ʒ�
���ͼ�¼�µIJ��Խ����
��ҩ������ҵ���ļ�ϵͳ��ָ�ᴩ����ҩ��������ȫ���̡����������ϵͳ�ļ����ļ�ϵͳ����ҩ������ҵʵʩ��ҩGMP�����Ļ�����һ���������õ���ҩ������ҵ�������Ƚ��ij������豸��Ӳ����֧�ţ�ҲҪ����������������������ҩ���������У�Ҫ��������Ҫ�����ֹ涨��һ��Ҫ���涨���£�һ�лҪ��¼�ڰ���һ��Ҫ������˵����һ�й���Ҫ����ǩ�ָ���
�ļ���������ҩ������ҵ������֤��ϵ����Ҫ���֣���ָ�����ļ�����ơ��ƶ�����ˡ������ַ���ִ�С��鵵�Լ��ļ������һϵ�й��̵Ĺ�����������ʵʩ��ҩGMP����ҩ������ҵ����Ϊһ���������ˣ��ļ��ɿ�������Ԫ���ļ�ϵͳ�ɿ���Ϊ��ϵͳ�����ļ�������ɿ���Ϊ��ϵͳ�ĵ��ػ���ļ�����������֤����������ҵ����ϵͳ�Ľ�ȫ����ת�����ļ��������������������Բ���ȱ�ٵġ�
�����ƶ���ҩGMP�ļ�������
��ҵӦ�Թ�����ϵ�в��õ�ȫ��Ҫ�ء�Ҫ��涨���Ƴɸ����ƶȡ���������γ��ļ�ϵͳ������֤��ҵԱ�����ļ�����ȷһ�µ����⡣��ʵʩ�м�ʱ��ȷ�ؼ�¼ִ������ұ���������ִ�м�¼��
�ƶ���ҩGMP�ļ�������ɸ���Ϊ��
1����ҵ�������������� ��ҩGMP�ļ�ϵͳ�������еIJ�Ʒ�����պ��ղ���ֱ�����տ��ơ��м��塢�м���̿��Ʊ���������ԭ�Ϻͳ�Ʒ�������鷽������ֹ������Ⱦ�Ĺ����������̵ȡ����������������������ݣ�ʹ������ҩ���������¿�ѭ����
2��֤�� ϵͳ���ļ�¼�ļ���������֯�ڲ���ͬ����һ��֤������˭��ʲôʱ�䡢��ʲô���ɵĽ����Σ�˭����һ���ȷ�ϡ���������ʹ��������֯�ӹ������������������а��ɲ�����״̬��������ȷ���κ��������������ṩ�����ݡ�
3�������Ľ���ԭʼ���� ���ݹ��ճ�������Ϳ��ƵĽ�������Եõ�������Ϣ�����²�����Ӱ��IJ������Ի���Ӱ��IJ������豸����IJ������ɱ���ɵȣ������з�����Ҫ�Ľ������IJ��֣�ͬʱ�����ļ���Ҳ�ɽ�ȷ�����Ľ����Ч����
4����Ա��ѵ�����۵ĸ��� �ļ�������Ϊ��ѵԱ���Ľ̲ĵ���ɲ��֣����ݹ��չ�̵ļ�¼�ļ���ͳ�ƣ�����Ϊ���۲�����Ա�Ƿ�ȷ��ִ���ļ��涨�ij����ṩ�������ݡ�����һЩ����ͳ�ƣ���ԭ�ϳ�Ʒ�ľ����ʣ��˿ͱ�Թ��������ȡ�����ؼ���������Լ�����ƫ��ȣ����Կ���������ϵ������ˮƽ����ij���š�ij��λ�IJ���ˮƽ��Ϊ������ƽ��ִ�м��������ṩ�������ݡ�
�ڶ����ļ�����
һ���ļ�ϵͳ
����ҩ������������淶������ʮ�����涨������ҩ������ҵӦ���������������������������ļ���������ƶȡ���¼�����ļ����ͷ�Ϊ�ƶȡ����ͼ�¼(ƾ֤)�����ࡣ
1�������ļ� ��Ҫ�ǹ��ڲ���Ҫ����ļ�����������������������������
(1)��������ָ��ҩ����������У��ɹ��ҡ��ط�����ҵ����ҵ�䲼���ƶ��ļ����淶���涨���취����������̺ͳ��������Ҫ�����Ʒ����������Ʒ���չ�̵ȡ�
(2)��������ָ�ɹ��ҡ��ط������������Ű䷢���йط��桢�ƶȻ�涨���ļ��Լ���ҵ�ƶ��Ĺ����ƶȡ��涨������취������Ҫ���糧������ʩ���豸��ʹ�á�ά���������ͼ����ƶȣ����Ϲ����ƶȣ�����ҩGMP��ѵ���ƶȵȡ�
(3)��������ָ��ҵ�ڲ���ÿһ�������������ҵ���������ƶ��Ĺ涨�������������Ҫ�����˻���Ⱥ�Ĺ���Ϊ�����乤����Χ��ְ��Ȩ���Լ��������ݿ������涨�ı������������Ҫ������ָ�������������ֱ��������(S0P)�ȡ�
2����¼(ƾ֤) �ǹ��ڲ��������֤�ݵ��ļ�������ӳʵ���������ִ�������ʵʩ�����һ���Ϊ��¼��ƾ֤���ֱ���ȡ�
(1)��¼�����λ������¼����������¼������װ��¼�����������ձ����±�����������Ʒ���������¼������̨�˵ȡ�
(2)ƾ֤�����ʾ���ϡ�������豸�Ͳ����ҵ�״̬�ĵ���֤���������Լ�����֤���ļ��ȡ�
(3)���棺����ҩ���뱨�桢���ֹ����ܽᱨ�桢��Ʒ�����ۺϷ����Լ����౨����ȡ�
�����ļ���������繤����Ҫ���ϼ���������������������������ڼ�¼��ƾ֤��ר�ⱨ���С�
���ݸ����ļ������ϵ����ҵӦ�����ļ�ϵͳ����ȷ�ļ�����Ҫ��ݲ��š��������š�ִ�в��źͼ�鲿�š�
�ļ�ϵͳ�ɸ���Ϊ��8��1��
��ҵӦ�����ļ�ϵͳ����ȷ�ļ�����Ҫ��ݲ��š�
�����ؼ����ļ�
��ҩ������ҵӦ�߱����ļ������ټƣ�����������ҩ�����������������ļ��ο���)��������ҩGMP)Ҫ�����ٰ�����
1����������ƶȼ���¼
(1)��ҵ�������������������������������������ŵĸ�������ƶȡ�
(2)��������ʩ���豸��ʹ�á�ά���������������ƶȺͼ�¼��
(3)�������ա����Ź����ƶȺͼ�¼��
(4)�����������������顢��Ʒ���ۡ��û�Ͷ�ߵ��ƶȺͼ�¼��
(5)�������������豸����Ա�����յ����������ƶȺͼ�¼��
(6)���ϸ�Ʒ�����������˿�ͱ��ϡ�����������������ϴ������ƶȺͼ�¼��
(7)���淶����ѵ����λרҵ������ѵ���ƶȺͼ�¼��
2����Ʒ���������ļ� ��Ʒ���������ļ���Ϊ���¼������͡�
(1)�������չ�̡���λ����������������(SOP)��
(2)��λ������¼����������¼������װ��¼��
(3)������` ��ָÿһ�����ϻ��Ʒ����������йصĸ��ֱ�Ҫ��¼�Ļ��ܣ���Ʒ�������Ľ��������ڲ�Ʒ�����������Լ��ݲ鿼��
3����Ʒ���������ļ�
(1)��ҩ������������ļ���
(2)���ϡ��м��Ʒ�ͳ�Ʒ������������������̡�
(3)��Ʒ�����ȶ��Կ����ļ���
(4)�������¼��
�������ļ����ƶ�
һ���ļ�����Ӧ��ѭ����ԭ��
1�������� �ļ�����������ָ��ҵ�ƶ����ļ�Ӧ������ף�ʹ�����š������ڶ��ܰ��ļ��涨�Ļ��������������ת��ʹ�����š������ڶ������Լ������ٽ����������״̬����������Ӫ����ļ����������Ʊ���ɾֲ���ת���飬Ӱ�����幦�ܵ��������ӡ�
2��Э���� �ļ���Э������ָ��������Э����������������Ӧ���Ϲ����йط��棬����������ҵ�ڲ���ϵͳӦЭ��һ�¡��¼��ƶ����ļ��������ϼ����йع涨��ִ���ͬ������ҵ�ڲ��������ƶ����ļ����������ì�ܡ�
�����ǹ��ҡ���������ļ������֣���ҵ���ƶ����ʱ���ܽ����ǿ�ѧ�����ϵ��Ƚ��ԡ�ʵ���Ժͱ���ҵ��Ч�棬�����˹��ҵ��йط��棬ʹִ���������ʴӡ�
3��ȷ�� �ļ���ȷ����ָ�ļ�����������Ҫȷ���ļ��ı��⡢����Ӧ���������Ͻ���

�����������ô�ȷ�У���ֹ�Ӳ�ͬ�ǶȲ�����ͬ������ͽ��͡��ļ�Ӧ���з������İ��ȷ��ʩ�����������ķ硣��д�ļ�ʱ��Ӧ����Χ���ļ����ƶ�Ŀ�ģ�Ҫ�����ĺ��ô�ȷ����������ͬ�������������ⲻ���õ���Ƨ�ʡ����Ի�����������⡢���ֽ��͵Ĵʾ䡣������ҲӦ��ȷ����
4����ȷ�� �ļ�����ȷ����ָ�ļ���ͼ�����������֡���ʽ�ȼ������ݺ�Ŀ��ֵӦ����ȷ����Ҫ������һ�㣬�������Ⱦ����ϸ�Ŀ�ѧ��֤����ȷ����ѧ������Ƶ���
5��һ���� �ļ���һ������ָ�ļ��е�������š����ŵȣ�ǰ��Ӧ����ͳһ�ġ�һ�µġ�ͬһ����Ӧ����ͬһ���ͬһ����Ӧ����ͬһ���ͬʱӦ����������ļ���һ�¡��ڲ�ͬ����ҵ��ͬһ������в�ͬ�Ķ��壬�ƶ��ļ�ʱ��Ӧ���Ա���ҵΪ��ͬһ��ҵ���ļ�Ӧ��������ȫ��ҵ�����ļ���һ���ԡ�
6���ɲ����� �ļ��Ŀɲ�������ָ�ƶ����ļ�Ӧȷ���ܹ�˳���ִ᳹�У����ܲ���Ӧ�е�ִ��Ч����Ϊ������һ�㣬���ܹ�������ָ�꣬Ӧ��������ΪĿ��ֵ��������������������������ָ�꣬ʹ�ļ��ܹ�����۶ȵصõ��᳹��ͬʱҲ���ڼ��ִ�������
7����̬�� ��ҩ����������������һ�������Ľ��Ķ�̬���̣���ˣ��ļ�����������֤���ճ���صĽ������������
8�������� ��ҵӦ���ݱ���ҵ��ʵ�����������Ч������Ҫ���ƶ�����ʵ���е��ļ���
9�������� �ļ�����д��Ӧ�ô�ȷ�У���ģ�����ɣ���Ӧ������
10�������� �ļ��еı�����������Ҫ�أ���¼��ӳ��ִ�еĹ��̣��ļ��Ĺ鵵Ҫ��ֿ����������Ҫ��Ϊ��ҵ�ij����Ľ��춨������
�����ƶ��ļ��ij���
���������������������ļ��ƶ�Ҫ������ݡ���顢������Ч�������ͷϳ��ȳ����������Ҳ��һ��SOP��
1����������ļ�����֯���� ��ҩ������ҵҪ����һ���ɼ����������ܹ���ʦ�����������������˻����������˸�����ļ���ݵ���֯�������û������ƿ��Գ�Ϊ����ҩGMP�ļ�����ίԱ�����������ҩGMP�ļ�����쵼С������������������dz���Ļ�������ʱ������
����ļ����쵼����������Ҫ����ҵʵʩ��ҩGMP��ʵ�ʳ�����ȷ���ļ��ƶ�������������ѡ�ϸ���ļ������Ա����������ļ�����ع涨��Ҫ��
��֯�����Ľ���������ʹ�ļ��ƶ�����������ЧЭ�����������õ����á�
2��ѡ�úϸ���ļ������Ա ��ҩGMP�ļ������Ա����������õ����ʣ����ܹ�����Ľ���(������ҩGMP��ѵ)������ʵ��������ʸ����������ڹ��������������˺��������ڳе����Σ�����Э���������Բ�ƷҪ�и߱��ͳ����Ľ��ĸ��ʵ���ϣ����ļ�Ҳ��Ҫ�и߱��ͳ����Ľ��ĸ��
��ҩ������ҵ��ҩGMP�ļ������һ��Ϊֹ���������š������������š���Ʒ���۲��ŵĸ����ˣ��������ǵ���Ȩ��Ա���糵�似�����Ρ����乤��ʦ�ȡ�
3������ļ� �ļ��������Ҫ���ļ�ʹ�ò��Ÿ���Ӧ��֤�ļ���ȫ���Ժ�ȷ���ļ��������ʮ�ֹؼ��ģ�Ӧ��ר�˸�����֯�й���Ա���ļ�Ӧ�߱������ݼ��йر�д��ʽ�Ĺ涨�����д���ļ�����˰��ļ���ʽ���ļ��ǼǺ�����ı���ȷ���ļ����ŷ�Χ��
�ļ��ݰ���������֤���ų�����ɰ칫�ҷַ����ļ��йز�����˲�ǩ��������ٽ�������ģ������������֤���Ÿ����˶��塣�ı������ǩ�������븴���˼�����ǩ����ǩ�������ò�����ɫ��īˮ�ʡ�Ȼ��ԭ���������ļ������ļ�����Ա�����⣬Ӧ��ǿ���������ļ���ǩ��ͬʱӦǩ�����ڡ����в�ͬ�������������֤�������˲ö���һ��Ҫ��ֹ�ļ���Ƭ���ԣ�ǿ���ļ��Ŀ����Ժ�ȫ���ԡ�
4���ļ���������Ч ����Ӧ���ŵIJ��ž�����������������������������¼(�հ�)����֤�ļ���Ӧ��������֤�����������漰ȫ�����ļ���Ӧ��������֤����������ˣ��ܹ���ʦ�������������Ա�֤�ļ���ȷ�Ժ�Ȩ���ԡ�
�ļ��������Ҫ���ǣ���������ҩGMP���Ƿ�������ļ����ݵĿ����ԣ��ļ�Ӧ������ȷ�С������������������ϵĽ��ͣ�ͬ��ҵ����Ч�������ļ�û����㣵ĺ��塣
�ļ��������������ˡ�����ˡ�����ǩ�֣���ע�����ڷ�����Ч��
5���ļ��������ͷϳ� ��������Ϊ�ļ�����Ŀ���䣬�������ݸı���٣�����Ϊ���������ϳ���Ϊ�ļ�����Ŀ�ı䣬���ݲ��۱�䣬ԭ�ļ����Ʒϳ��������ļ�Ӧ��ԭ��������������
�йز��Ŷ�ԭ�ļ���������ʱӦ��д�������ļ��������������������֤������ˣ������йس���涨�����������������֤���Ž�������Ч�ļ�֮��ӡ��������ز��ţ�ͬʱ�ջ�ԭ�ļ����٣��������ֳ�����ԭ�ļ���
�ļ��ķϳ����йز�����������������������֤������ˣ���������֤������ˣ����������ϳ����ļ���Ӧ��������֤��������֪ͨ�йز��ţ��ڷַ�֪ͨ��ͬʱ���ջر��ϳ����ļ���ʹ�䲻���ֳ����֡�
�����ƶ��ļ���Ҫ��
����ҩGMP������ʮ�����涨���ƶ����������������ļ���Ҫ��
(1)�ļ��ı���Ӧ�������˵���ļ��ļ��ʡ�
(2)�����ļ�Ӧ�б���ʶ���ı�������ϵͳ��������ڡ�
(3)�ļ����ݵ���дӦ��ʵ����������������Ϳ�ģ���ȷ���ģ���ǩ���ͱ������ڣ���Ӧʹԭ�����Կɱ��ϡ�
(4)�ļ�����ʹ���ڳ�����
(5)�ļ��ƶ���������������Ӧ��ȷ������������ǩ����
���Ľ� �ļ�����
һ���ļ�����Ӧ��ѭ��ԭ��
(1`)�����ļ�Ӧ��ͳһ��ţ����в�ѯĿ¼���Է������ĺ�����
(2)�ļ�Ӧ�������ģ���ʱ��������ִ�е��ļ�Ӧ���Գ���������Ŀ¼����ע�����ļ�һ����������ԭ�ļ�Ӧ���Է�ֹ��������������ͨ�����г��֣�����������ҡ�
(3)��ҵ���㵥λ������ļ���Ӧ��ר�˸��𱣹ܣ������ļ�����˽�Դ������������ⶪʧ��й�ܡ�
(4)�����¼Ӧ��ר�˸��ˣ��Բ�������д�涨���д���ĵط���Ӧ��ʱ������д�˾��������˲�������Ϳ�Ļ�α�졣
(5)�����䡢��λ��������йؼ�¼Ӧ��������ᡢһ�£�ͬһ����Ʒ�ĸ��йؼ�¼��Ӧ����ì�ܻ����ݲ����νӡ�
(6)����������¼Ӧ����������Ʒ��Ч��(������)��һ�꣬������ǰ���٣��Ա��֤��
(7)�����ļ�����ʹ���ֳ�������ӡ����Ӧ��������ȫһ�£���������˸Ķ��Ŀ����ԡ�
(8)�����ļ���ҳ�������ȷ����ȫ����������˺�٣����ĸ�������Ϳ�ġ����������Ӧ�Ȼ�ȥҪ�ϳ�������(Ӧ���ܱ���ԭ���ּ�)�������Ա���д�����֣���ǩ������ֹʹ��Ϳ��Һ��Ƭ������ֶ��ġ�
(9)�ļ��ı�����鵵Ӧ���Ϲ��ҡ��ط�����ҵ�йع涨��Ҫ���������ҷš���ʧ�������ȡ�
������¼��дӦ���صĹ涨
(1)����Ҫ��ʵ�����ö���
(2)Ҫ��ʱ��д�������ǻǡ�
(3)�ּ��������������������˲ݡ�
(4)����ʹ��Ǧ�ʣ�����ĥ�������Ķ���
(5)��������Ӧ��д��ȫ���������пո���������дʱ��Ҫ����������ʾ��������ǰ����ͬʱ��Ӧ�ظ���д��������������������ͬ��������ͬ�����ȱ�ʾ��
(6)Ʒ�����ü�д������ʹ�����������������
(7)�����ߡ������ߵ�ǩ��������ȫ����������ֻд�ջ�ֻд��������ͬ�ճ�ͬ������⡣
(8)����һ�ɰ��ꡢ�¡���˳����д����ݰ���λ����д���¡���Ӧ����λ����д��
�����ļ�������ʹ��
�ļ��Ĺ�����ָ�����ļ�����ơ��ƶ�����ˡ������ַ���ִ�С��鵵�Լ��ļ������һϵ�й��̵Ĺ��������ˣ���ҵӦ�ƶ��ļ������ƶȡ����ݰ��������ļ��ı��ܺ鵵Ӧ����Ҫ����������¼Ӧ����3����Ʒ��Ч�ں�1�ꡣ
l���ļ��ı��� �����ļ�������ϵͳ�ı��뼰���ţ��ļ��ı��������Ӧ�������£��Ա���ʶ�𡢿��Ƽ��٣�ͬʱ�ɱ���ʹ�ûŹ�ʱ���ļ���
�ļ�����Ҫע�����µ�Ҫ��
(1) ϵͳ�ԣ�ͳһ���ࡢ���룬��ָ��ר�˸�����룬ͬʱ���м�¼����
(2)ȷ�ԣ��ļ�Ӧ�����һһ��Ӧ��һ��ijһ�ļ���ֹʹ�ã����ļ����뼴�����ϣ��������ٴ����á�
(3)�����ԣ������ļ�����ϵͳ�Ĺ涨������������ļ��������ʱ�����ļ��������ʷ��
(4)�ȶ��ԣ��ļ�ϵͳ����һ��ȷ����һ������²�������䶯��Ӧ��֤ϵͳ���ȶ��ԣ��Է�ֹ�ļ������Ļ��ҡ�
(5)���һ���ԣ��ļ�һ�Ҿ����������뼶���µı��룬��������ļ��г��ֵĸ��ļ�����ͬʱ����������
2���ļ��ķ��� �ļ�����Ա���յ�������ļ�ԭ���������ļ����ַ�Ŀ¼��ӡ��Ӧ�����ַ�����Ӧ��Ա�������ü�¼����ӡ��Ӧ�������ɱ档�ļ������������ļ��ַ��ǼDZ���ǩ����ָ�����ļ��ڷ����°汾��ͬʱӦ�ջؾɰ汾�����DZ�֤�ļ��ܿص���Ҫ��ʩ�����ŵ�ӦΪ��ʽ��ӡ���������Ϻ�ӡ�¡�
3���ļ���ִ������ ���ļ�ִ����ʼ�Σ��йع�����Ա�����μ���ļ���ִ����������DZ�֤�ļ���Ч�Ե���ؼ�������ͬʱ�ļ���������Ӧ������ʹ�ú��������ṩ�����ļ��嵥������ʹ�ù��ھ��ļ��������ļ�Ӧ���ڸ��ˣ�����ļ������Զ����ƺ���ϵͳ��ֻ��������Ȩ�˲�����
4���ļ���ʹ������ѵ Ϊȷ���ļ�����ȷִ�У�Ӧ�ƶ�����ʹ�ù�����ʩ��
(1)�����ļ����Ƽ�¼(������)���ַ��ļ�ʱ��������ǩ����
(2)�����ļ���Ŀ¼(������)�������°��ļ�ʱͬʱ�ջؾɰ��ļ������ļ�������Աͳһ�������Ա���ľɰ��ļ�Ӧ�������Ա�ʶ���������ļ����뱣�档
(3)�ƶ������ļ��嵥(������)������ʱ���������ļ���״̬��
(4)�ļ��ĸ������ļ���������ͳһ����������˺�Ӹ�ӡ�£��ǼǷ��š�
�ļ���ִ��ǰӦ���ļ�ʹ���߽���ר����ѵ����֤ÿ���ļ�ʹ����֪�����ʹ���ļ���
5���ļ��ı�����鵵 �ַ��������ļ�����Ա�轫ԭ���鵵���鵵����ļ�����ڲ��ҡ��ļ����������ļ����ͬ���졣��������¼�ȣ�һ�㱣������Ʒ��Ч�ں�1�ꣻ���ڱ�������̵ȣ�ԭ��һ��Ӧ����6�ꡣ�����ļ�Ӧ������ר��Ŀ¼�У���Ϊ���ӱ��ݡ�
��Ʒ���չ�̡���Ʒ����������Ʒ���ļ��Ȳ�������ҵ���о����ĵ��ļ��˵�����š�
��¼���ļ�����ԭ�ϡ���װ���ϼ���Ʒ������¼Ӧ����ҩGMP�淶�涨���棻�¶ȡ�ʪ�ȼ��յ�����ϵͳ�����м�¼����֤��¼��ά��¼��ƫ������ܵ�Ѫ����ҵ����ʵ������ƶ��鵲���������ޡ����������ϻ�Ӧ���ǰ�ȫ�����Ҫ�����Ʒ�������ķ���Ӧ�ܷ�����ŷ���ҹ涨������120min֮�ڣ�����Ӧ�����ƻ�����Щ���ɲο���
�ļ��Ĺ鵲���������ļ����ּ�¼�Ĺ鵵���ļ��������ű���һ�������ļ����������������ļ���������ʱ���¼�¼�ڰ������ּ�¼��ɺ���������鵵���������涨���ޡ�������������¼���û�Ͷ��¼���˻�������Ӧ���ڽ���ͳ�����ۣ�Ϊ�����Ľ��ṩ���ݡ�
�ļ�������鵵Ӧ���Ϲ��ҡ��ط��йط���Ҫ���ƶ���ҵ�ļ����������ƶȣ��������ļ����ܼ�¼������������¼Ӧ��������3�������Ʒ��Ч��(������)��1�ꡣ
6���ļ��ı�� �ļ�һ���ƶ���δ��������������ġ�������ĵ�Ӧ������ɣ����йس���ִ�С����ļ���ʹ�ü�������Ա������ɣ����������룬�������ļ������ˣ��������۱�������Ժ�ǩ�����������ļ��ٰ����ļ���ݳ���ִ�С��ļ��������Ÿ������ļ�����������������ļ��ı����������������¼�ڰ����Ա���ټ�顣
7���ļ������� �ļ��������������ļ������Ҹ������������ļ���Ӧ�Ļ��ļ������ң����ļ�����Ա�ռ���ͳһ���١�
�ļ�Ӧ�������ģ���ʱ���������ļ����ġ���������������ļ��ġ����ġ�������Ӧ���ƶ�ʱ��ͬ��
�ļ�һ������Ӧ���������ļ�������ļ�(���¼�����桢�����)�Ƿ�Ӧ����Ӧ������
8���ļ������ij����Ľ� �ļ�����Ӧ���ϵس����Ľ�����Ľ��ķ���һ�Ǽ����������̣������м价�����Ǽ����������ʵ���ļ�������ֽ���������ִ��ļ�������Ŀ�꣬Ҳ��ʵʩ��ҩGMP�ر������������������������ļ��γ����ڣ����ٷ��㣬�Զ����棬Ҳ�ܹ����ٶ�Ա�����Ч�ʡ�
��ҩ������ҵ���ļ�������ʵʩ��ҩGMP�����Ļ����������Ľ��ļ�����������������Ҫ��������ȷ�����������쵼���ƣ���ȷ�������ֹܵ��쵼���������������������䱸����������Ա���γɵ����������硣��������ʵ���������ƶȡ��������ͽ�ȫ�����ļ������γɡ����ۡ��鵵�Ŀ�����ϵ��
�ġ��ļ�����ְ��
1�����ž��� ���ž�����ְ��ɸ���Ϊ���¶��㣺
(1)ȷ������������ָ�����ļ�����Ա�����ĺ�ʹ�ò�����ִ�С�
(2)ֻ�������ڱ����ŵ���Ч�ļ���
(3)ÿ��Ӧ���Ƕ�ָ�����ļ���������
��������̺ͼ��鷽����Ӧ����Ա�����ڲ��ĵĵط����������������̨�ԣ�����ڹ̶��ļ����С�Ӧȷ��ÿλԱ����֪���ںδ��ɲ��ҵ���������̻���鷽������Ҫ���������ļ��뱾�����ص��ļ����Է���������ȷ���ⷽ�����ϣ��ɵ��ļ�����Ա�����ġ�ָ�����ļ�һ����涨�����ڣ��������������ļ����ݲ���ʵ���Ա仯������İ沢���ļ������������·��ţ���Ŀ������ÿ��һ���ھ����ٴ�ȷ�ϴ��ļ��������ޱ仯��
2���ļ��ռ��� ���ַ�Ŀ¼���漰���ˣ���������
(1)���ļ�Ҫ������
(2)���ļ��ƶ��������Ҫ��
(3)������Ч�ļ���ȷ������Ϊ��Ч�ļ���
3���ļ�����
(1)�ƶ��ļ����ϵͳ��ȷ��ÿ���ļ���һר�õĹ�ǼǺ��ұ��ڼ�����
(2)���ļ����еǼǡ�
(3)ͨ���ļ�����������°��ļ��ַ�ͬʱ�������ɰ��ļ����ϡ�
(4)���ջص������ļ��������١�

��һ �����ļ�����Ŀ¼
1. �ļ������ƶ�
2. �ļ���ʽ�������������涨
3. ���������ƶ�
4. ��¼��д�йع涨
���� ���¼�¼����Ŀ¼
����8��1�ļ����Ƽ�¼
����8��2�ļ���Ŀ¼
����8��3�����ļ��嵥
����8��4�ļ����ܼ�¼
������Դ��http://www.iwuchen.com/
GMP��:ҩƷ�������������淶(2010����)(���������79�ţ�
�°�GMP��:ҩƷ�������������淶��¼1-��ҩƷ
ҩƷ�������������淶��֤�����취(����2011��ȫ��)
��һ����GMP�������̱������ֲ���һ����ҩ��GMPʵʩ�Լ��
��������
- �� ��ҩƷ�������������淶��2010��������������Ʒ�����
- �� ҩƷ�������������淶����ҩƷ����ҩƷ��ҩƷ���������
- �� �°�GMPҪ��ԭ��ҩ����������ֳ�GMP����ϸ��
- �� ����ʡҩƷGMP��֤������
- �� ���ӭ��GMP��֤��飿
- �� ҩƷ�������������淶��¼5-��ҩ�Ƽ�
- �� ҩƷ�������������淶��¼4-ѪҺ��Ʒ
- �� ҩƷ�������������淶��¼3-������Ʒ
- �� ҩƷ�������������淶��¼2-ԭ��ҩ
- �� ҩƷ�������������淶��¼1-��ҩƷ
���ڡ���ɽ����ݸ����ɽ�����š����ݡ����ݾ������̹�˾|������|�ྻ��|����|��������|��������|�ྻ����|�ྻ����|�ྻ��|GMP����|GMP�����ȿյ��ྻ����ʩ��������
��չ�Ķ���10���������|ʵ�鶯�﷿|�������|�ྻ�һ�������|�ྻ�����ҹ淶|GMP�ྻ�ȵȼ�|ʳƷ���������淶|�ྻ����ʩ��Ҫ��|��������װ�淶
Copyright © 2012-2018


